Приложение к Словарю отходов Категории отходов — Классификация вредных веществ
Приложение к Словарю отходов
Автор — составитель: Обухов Евгений Николаевич
Категории отходов — Классификация вредных веществ
Категории отходов
Q I Отходы, образуемые в процессе производства или потребления, никакие другие из перечисленных ниже
Q 2 Продукция, не отвечающая техническим условиям
Q 3 Продукция, с истекшим сроком использования
Q 4 Пролитые, рассыпанные, разбитые, испорченные или претерпевшие другие разрушения материалы, включая материалы, оборудование и т.д., ставшие вредными в результате неприятных происшествий
Q 5 Материалы, зараженные или загрязненные в результате запланированных действий (например, отходы, образующиеся при работах по очистке, упаковочные материалы, тара и т.д.)
Q 6 Детали и части с истекшим сроком эксплуатации (например, отработавшие свой срок батареи, истощившиеся катализаторы и т.д.)
Q 7 Вещества, утратившие свои эксплуатационные свойства (например, загрязненные кислоты, загрязненные растворители, отработанная соль, использовавшаяся при закалке материалов и т.д.)
Q 8 Отходы промышленных процессов (например, шлаки, кубовые остатки и т.д.)
Q 9 Отходы, образующиеся в процессе борьбы с загрязнением (например, осадки в газоуловителях, пыль в тканевых фильтpax, отработанные фильтры и т.д.)
Q 10 Отходы, образующиеся при механической обработке на станках и при чистовых отделочных операциях (например, стружка с токарных станков, окалина с
прокатных станков и т.д.)
Q 11 Отходы, образующиеся при добыче сырья и его обработке (например, отходы шахт, некондиционные нефтепродукты в местах добычи нефти и т.д.)
Q 12 Материалы, испорченные примесями или разбавлением (например, нефтепродукты с примесями полихлордифенилов и т.д.)
Q 13 Любые материалы, вещества или продукты, использование которых запрещено законом
Q 14 Продукты, уже не используемые их владельцем (например, в сельском хозяйстве, в быту, в учреждении, в торговых организациях и т.д.)
Q 15 Испорченные материалы, вещества или продукты, образуемые при восстановительных работах, связанных о землепользованием
Q 16 Любые материалы, вещества или продукты, не относящиеся к перечисленным выше категориям
Директива Совета Европейских Сообществ 75/442/ЕЭС от 15 июля 1975 года Об отходах Приложение I
Класс опасности отходов производства и потребления. В настоящее время в России для отходов в соответствии с приказом Министерства природных ресурсов РФ от 15.06.2001 года № 511 установлено 5 классов опасности.
| КЛАСС ОПАСНОСТИ отхода для окружающей природной среды | СТЕПЕНЬ вредного воздействия опасных отходов на окружающую природную среду | КРИТЕРИИ отнесения опасных отходов к классу опасности для окружающей природной среды |
| I КЛАСС
ЧРЕЗВЫЧАЙНО ОПАСНЫЕ |
ОЧЕНЬ ВЫСОКАЯ | Экологическая система необратимо нарушена. Период восстановления отсутствует |
| II КЛАСС
ВЫСОКООПАСНЫЕ |
ВЫСОКАЯ | Экологическая система сильно нарушена. Период восстановления не менее 30 лет после полного устранения источника вредного воздействия |
| III КЛАСС УМЕРЕННО ОПАСНЫЕ | СРЕДНЯЯ | Экологическая система нарушена. Период восстановления не менее 10 лет после снижения вредного воздействия от существующего источника |
| IV КЛАСС МАЛООПАСНЫЕ | НИЗКАЯ | Экологическая система нарушена. Период самовосстановления не менее 3-х лет |
| V КЛАСС ПРАКТИЧЕСКИ НЕОПАСНЫЕ | ОЧЕНЬ НИЗКАЯ | Экологическая система практически не нарушена. |
Википедия, сайт http://ru.wikipedia.org
Класс опасности по ГОСТ 12.1.007-76. Стандарт ГОСТ 12.1.007-76 «Классификация и общие требования безопасности» устанавливает следующие признаки для определения класса опасности:
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности:
| I | вещества чрезвычайно опасные |
| II | вещества высокоопасные |
| III | вещества умеренно опасные |
| IV | вещества малоопасные |

Класс опасности вредных веществ устанавливают в зависимости от норм и показателей, указанных в таблице:
| Наименование показателя | Норма для класса опасности | |||
| I | II | III | IV | |
| ПДК вредных веществ в воздухе рабочей зоны, мг/м3 | < 0,1 | 0,1—1,0 | 1,1—10,0 | > 10,0 |
| Средняя смертельная доза (LD50) при введении в желудок, мг/кг | < 15 | 15—150 | 151—5000 | > 5000 |
| Средняя смертельная доза при нанесении на кожу, мг/кг | < 100 | 100—500 | 501—2500 | > 2500 |
| Средняя смертельная концентрация в воздухе, мг/м3 | < 500 | 500—5000 | 5001—50000 | > 50000 |
| Коэффициент возможности ингаляционного отравления (КВИО) | > 300 | 300—30 | 29—3 | < 3 |
| Зона острого действия | < 6,0 | 6,0—18,0 | 18,1—54,0 | > 54,0 |
| Зона хронического действия | > 10,0 | 10,0—5,0 | 4,9—2,5 | < 2,5 |
Отнесение вредного вещества к классу опасности производят по показателю, значение которого соответствует наиболее высокому классу опасности.
Чрезвычайно опасные вещества (I):
Акролеин — Бензапирен — Бериллий — Диэтилртуть — Линдан (гамма—изомер ГХЦГ) — Озон — Пентахлордифенил — Ртуть (суммарно) — Тетраэтилолово — Тетраэтилсвинец — Трихлордифенил — Этилмеркурхлорид — Таллий — Полоний — Плутоний — Протактиний — Оксид свинца — Растворимые соли свинца; Теллур; Фтороводород
Высокоопасные вещества (II):
Атразин — Бор — Бромдихлорметан — Бромоформ — Гексахлорбензол — Гептахлор — ДДТ (сумма изомеров) — Дибромхлорметан — Кадмий (суммарно) — Кобальт — Литий — Молибден (суммарно) — Мышьяк — Натрий — Нитриты (по NO2) — Свинец (суммарно) — Селен — Сероводород — Силикаты (по Si) — Стронций (Sr2+) — Сурьма — Формальдегид — Фенол — Фипронил (Инсектицид РЕГЕНТ 800 в.д.г.) — Фосфаты — Хлороформ — Цианиды (по CN-) — Четыреххлористый углерод- Хлор (Cl) Трихлорсилан (Cl3HSi)
Умеренно опасные вещества (III):
Алюминий — Барий — Железо (суммарно) — Марганец — Медь (суммарно) — Никель (суммарно) — Нитраты (по NO3) — Серебро — Фосфаты (PO4) — Хром (Cr6+) — Цинк (Zn2+) — Этиловый спирт (H3C — CH2 — OH)
Малоопасные вещества (IV):
Симазин — Сульфаты — Хлориды
Википедия, сайт http://ru.wikipedia.org
Кластер (англ. cluster) — (от англ. cluster — рой, скопление) — компактная обособленная группа связанных друг с другом атомов, молекул или ионов, которая обладает свойствами, в той или иной степени отличными от свойств составляющих ее элементов.
Описание
Под кластерами в разных областях знания понимают весьма различные объекты. В ядерной физике кластерами называют коррелированные группы элементарных частиц. В химии и материаловедении под кластерами чаще всего имеют в виду одно из промежуточных состояний в организации вещества между одиночным атомом (молекулой, ионом) и твердым телом (наночастицей).
Согласно последней точке зрения, кластер представляет собой группу из небольшого, нередко переменного, числа взаимодействующих атомов, ионов или молекул. В зависимости от типа объединяемых частиц, кластеры подразделяют на атомные, ионные и молекулярные; в зависимости от состава — на металлические, углеродные и т. д.
К кластерам имеет смысл относить частицы такого размера, для которых наблюдаемые свойства существенно отличаются от свойств макрообъекта или наблюдаемо меняются при добавлении еще одного составляющего элемента. Например, можно говорить об электронном спектре еще дискретного, а не зонного типа. Таким образом, речь идет о частицах размером не более одной-двух тысяч атомов, часто — заметно меньше.
При этом может наблюдаться немонотонная зависимость свойств от размера кластера, в особенности для небольших кластеров, где при разных размерах могут проявляться различные конкурирующие структурные типы.
Большинство методов получения металлических кластеров основаны на испарении металлов, сплавов и бинарных соединений при помощи термического, плазменного, электронно-лучевого и лазерного воздействия с последующей конденсацией. Основным требованием к условиям конденсации является обеспечение высокой скорости зародышеобразования при минимальной скорости роста образующихся частиц, что может быть реализовано при максимальной скорости охлаждения конденсируемых паров (сверхзвуковое истечение пара металла в вакуум, испарение в разреженной атмосфере инертного газа и пр.).
При синтезе и исследовании кластеров активно используется метод низкотемпературной матричной изоляции (см. также криохимия). Существование кластеров возможно и в газовой фазе; строение и состав кластеров при этом могут заметно отличаться от свойств кластеров в конденсированном состоянии. Для исследования процессов кластерообразования в этом случае активно используется масс-спектрометрия и различные спектроскопические методы анализа газовой фазы.
Наряду с кластерными частицами металлов и сплавов, существуют также кластерные соединения, в которых металлическое ядро стабилизировано лигандами, иногда весьма сложного химического состава. Молекулы таких соединений содержат окруженный лигандами остов из атомов металлов, находящихся на расстояниях до 0,35 нм, допускающих прямое взаимодействие металл-металл. По числу атомов металла, образующих остов кластерного соединения, нуклеарности (q), кластеры делят на малые (q = 3–12), средние (q = 13–40), крупные (q = 41–100) и сверхкрупные, «гигантские» (q > 100).
Кластерные соединения характерны как для переходных металлов, так и для многих непереходных элементов. Известны гомометаллические кластеры, остов которых состоит из атомов одного металла, и гетерометаллические кластеры, содержащие в остове атомы двух, трех и более металлов. Металлический остов в молекулах кластеров покрыт плотным слоем лигандов, как концевых, так и мостиковых. Лигандами могут быть как отдельные атомы (H, Cl, Br, I, Se и др.), так и группы атомов или молекулы (CO, NO, олефины, арены и др.). Иногда моноатомные лиганды (N, C, H, P и др.) расположены внутри полостей металлического остова, имеющего с внешней стороны другие лиганды.
Еще одним важным классом кластерных соединений являются кластеры полупроводниковых веществ, например, селенидов или теллуридов кадмия. Синтез таких кластеров может осуществляться традиционными растворными методами металлоорганической химии, посредством травления макроскопических частиц материала, а также с помощью пористых матриц, для получения частиц нужного размера. Как и в предыдущем случае, химическая устойчивость таких кластеров может достигаться посредством защиты их поверхности органическими лигандами или поверхностно-активными веществами (ПАВ).
Подобные кластеры могут использоваться в качестве квантовых точек, в частности — голубых светоизлучающих диодов, а также люминесцентных меток или объектов. В целом возможные применения металлических или полупроводниковых кластеров включают катализ, создание наноэлектронных устройств и метаматериалов, основанных на их пространственно упорядоченных массивах, например, фотонных кристаллов.
Среди других важных типов кластеров можно упомянуть коллоидные кластеры, фуллерены Cn (n ≥ 20) и их внешнесферные производные, эндоэдральные фуллерены M@Cn, металлокарбогедрены или меткары составом M8C12 (M — переходный металл: Ti, Zr, Hf, V, Cr, Mo и Fe), а также «неорганические фуллерены» — многослойные полиэдры из сульфидов молибдена или вольфрама и некоторых неорганических оксидов и галогенидов, часть которых проявляет высокие смазочные характеристики.
Иллюстрации
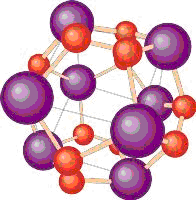 |
Молекулярный кластер Ti8C12 со структурой додекаэдра. Синим обозначены атомы титана, красным — атомы углерода. |
Авторы
- Гольдт Илья Валерьевич
- Гусев Александр Иванович
- Шляхтин Олег Александрович
Источники
- Золи // Химическая энциклопедия. Т. 2. — М.: Советская энциклопедия, 1990. С. 400–403.
- Гусев А.И. Наноматериалы, наноструктуры, нанотехнологии. — М.: Физматлит, 2007. — 416 с.
- Gusev A. I., Rempel A. A. Nanocrystalline Materials. — Cambridge: Cambridge International Science Publishing, 2004. — 351 p.
Словарь нанотехнологических и связанных с нанотехнологиями терминов. [Электронный ресурс]. — Режим доступа: http://thesaurus.rusnano.com — Название с экрана
Кизяк — высушенный навоз используется в качестве топлива (например, для сжигания в русской печи для обогрева или приготовления пищи). Например, по свидетельству этнографа и географа М. Песселя, в Гималаях в домашних печах «обычное топливо — ячий кизяк, причём, сгорая, он даёт удивительно приятный дым, отдалённо напоминающий ладан»
Изготовление. Описано на примере заготовки кизяка жителями Западной Сибири.
Навоз перемешивают с соломой, после нескольких дней отлежки смеси собираются группой жителей — «таскать кизяки» — обычно дети, женщины, пожилые мужчины, так как работа не слишком тяжела. Навозно-соломенная смесь перетаптывается для однородности состава людьми, обычно босиком, затем закладывается в деревянные специальные формы — нечто вроде ящика без дна.
У каждого человека, принимающего участие в изготовлении кизяков, своя форма, у многих эти формы передаются из поколения в поколение. Но смастерить её не сложно, хотя и изготавливать нужно из дефицитного в этой местности дерева. Форма для кизяка представляет собой рамку примерно 70 см на 50 см и высотой сантиметров 25 с ручкой — чтобы можно было нести смесь для сушки. Форму располагают в месте, находящемся недалеко (в двух-трёх метрах) от места, где находится кизячная смесь.
Кизяком называют (и считают в штуках) также массу смеси, находящуюся в одной форме или её части, выделенной перегородками.
Следующий этап: выложенные на травяном поле сырые кизяки должны просохнуть на солнце в течение нескольких дней пока не станут совершенно сухими. Поэтому дни не должны быть дождливыми — подходящие выбираются по народным приметам. Высохший кизяк, лёгкий и твёрдый, не рассыпается при ударе друг об друга или падении с небольшой высоты.
Заключительный этап: кизяки перевозятся на ручной деревянной тележке или на телеге, запряжённой лошадью, на хозяйственный двор и складываются для хранения в довольно высокую пирамиду, примерно метра два высотой с усечённым верхом.
Википедия, сайт http://ru.wikipedia.org
Кизяк — кизик (южная и юго-восточная Россия), ки (Общее название навоза у киргиз и, кроме того, частные: овечьего — кумалак (лучшее топливо), коровьего — джепа и конского — тезек. В Елецком уезде приготовляют кизяки из свиного навоза, из него же строят избы.) — высушенный навоз, употребляемый в южных безлесных местностях России как топливо (Губернии: Астраханская, Ставропольская, Самарская, Оренбургская, Саратовская, Херсонская (даже в городе Одессе), Екатеринославская, Воронежская, Курская, Полтавская, Эриванская и местами в Подольской, Бессарабской, Пензенской, Тамбовской и Орловской.).
Он или собирается по степи (Киргизской), или же накопляется на местах постоянного содержания скота — в загонах, оборах (Полтавская губерния), базах (Екатеринославская губерния) или кардах (юго-восточные губернии), затем с остатками корма укладывается на свободном месте вблизи жилья, поверх слоя соломы, где и остается до мая, когда поливается водой, если высох, перемешивается в течение дня топтанием волов или лошадей и хорошо сжимается укатыванием катком; затем топором или лопатой с железным наконечником (Для отопления городских печей, например в Одессе, кизяк формуется как обыкновенный кирпич или торф.) разделяется на кирпичины (16x8x3 вершка) и складывается в августе пирамидальными или коническими кучами — клетками — для просушки, после чего каждая кирпичина обмазывается раствором жидкой глины с пометом и остается в таком виде, прикрытая сверху от дождя слоем свежего навоза, до употребления.
Опытный рабочий приготовляет в день до 500 кирпичин, для удовлетворения же годичной потребности крестьянина в топливе требуется работа двух рабочих в течение двух недель. Кизяк трудно разгорается; обыкновенно кладут в печь 20 кирпичин (свиного меньше) и разжигают щепой. Горит кизяк без пламени и в ветреную погоду сильно портит воздух отапливаемого помещения выделяющимися из него газами неприятного запаха; тепла выделяет меньше, чем солома и гречневая лузга, обыкновенные суррогаты топлива в тех местностях, где употребляется кизяк, а именно по весу, относительно сосновых дров — 136,77:158,00:159,60:181,80 (по Никитскому).
Ср. «Записки Императорского Русского географического общества» (т. I, 1867); «Лесной Журнал» (1872, вып. 2-й); В. Т. Собичевский, «Лесной отдел московской политехнической выставки» (1872) и «Технический Сборник» (т. XXVII, 1878).
В. Собичевский.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон. 1890—1907, Сайт http://dic.academic.ru, Словари и энциклопедии на Академике
Кислотные осадки — дождь, снег или дождь со снегом, имеющие повышенную кислотность. Кислотные осадки возникают главным образом из-за выбросов оксидов серы и азота в атмосферу при сжигании ископаемого топлива (угля, нефти и природного газа). Растворяясь в атмосферной влаге, эти оксиды образуют слабые растворы серной и азотной кислот и выпадают в виде кислотных дождей.
Относительная кислотность раствора выражается индексом рН (кислотность определяется наличием свободных ионов водорода Н+; рН – это показатель концентрации ионов водорода). При рН = 1 раствор представляет собой сильную кислоту (как электролит в аккумуляторной батарее); рН = 7 означает нейтральную реакцию (чистая вода), а рН = 14 – это сильная щелочь (щелок). Поскольку рН измеряется в логарифмической шкале, водная среда с рН = 4 в десять раз более кислая, чем среда с рН = 5, и в сто раз более кислая, чем среда с рН = 6.
Обычная незагрязненная дождевая вода имеет рН = 5,65. Кислотными называются дожди с рН менее 5,65. На значительных территориях на востоке США, юго-востоке Канады и западе Европы среднегодовые значения рН атмосферных осадков колеблются от 4,0 до 4,5.
В восточных районах США кислотность атмосферных осадков приблизительно на 65% определяется присутствием серной кислоты (H2SO4), на 30% – азотной кислоты (HNO3) и на 5% – соляной кислоты (HCl). Главными источниками оксидов серы (SO2 и SO3), обусловливающих образование серной кислоты, являются тепловые электростанции, работающие на нефти и угле, а также металлургические заводы. Оксид азота (NO) и диоксид азота (NO2), из которых образуется азотная кислота, поступают в атмосферу примерно в равных количествах от тепловых электростанций, работающих на нефтепродуктах и угле, и с выхлопными газами автомобильных двигателей.
Сравнительно небольшое количество соляной кислоты в атмосферных осадках образуется в результате аккумуляции газообразного хлора от различных природных и промышленных источников. Кислотные дожди могут также выпадать при поступлении в атмосферу серной кислоты и азотсодержащих газов (диоксида азота NO2 и аммиака NH3) от естественных источников (например, при извержении вулканов).
Последствия. Разные природные обстановки различным образом реагируют на повышение кислотности. Кислотные осадки могут привести к изменению химических свойств почвы и воды. Там, где вода в реках и озерах стала довольно кислой (рН менее 5), например, в горах Адирондак (шт. Нью-Йорк, США) или в южных районах Норвегии и Швеции, исчезает рыба. При нарушении трофических цепей сокращается число видов водных животных, водорослей и бактерий. В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур.
ЛИТЕРАТУРА
Израэль Ю.А., Назаров И.М., Прессман А.Я. и др. Кислотные дожди. Л., 1989
Хорват Л. Кислотный дождь. М., 1990
Энциклопедия Кругосвет. 2008, Сайт http://dic.academic.ru, Словари и энциклопедии на Академике
Кислотные осадки — дождь, снег или дождь со снегом, имеющие повышенную кислотность. Кислотные осадки возникают главным образом из-за выбросов оксидов серы и азота в атмосферу при сжигании ископаемого топлива (угля, нефти и природного газа). Растворяясь в атмосферной влаге, эти оксиды образуют слабые растворы серной и азотной кислот и выпадают в виде кислотных дождей.
Относительная кислотность раствора выражается индексом рН (кислотность определяется наличием свободных ионов водорода Н+; рН — это показатель концентрации ионов водорода). При рН = 1 раствор представляет собой сильную кислоту (как электролит в аккумуляторной батарее); рН = 7 означает нейтральную реакцию (чистая вода), а рН = 14 — это сильная щелочь (щелок). Поскольку рН измеряется в логарифмической шкале, водная среда с рН = 4 в десять раз более кислая, чем среда с рН = 5, и в сто раз более кислая, чем среда с рН = 6.
Обычная незагрязненная дождевая вода имеет рН = 5,65. Кислотными называются дожди с рН менее 5,65. На значительных территориях на востоке США, юго-востоке Канады и западе Европы среднегодовые значения рН атмосферных осадков колеблются от 4,0 до 4,5. В восточных районах США кислотность атмосферных осадков приблизительно на 65% определяется присутствием серной кислоты (H2SO4), на 30% — азотной кислоты (HNO3) и на 5% — соляной кислоты (HCl).
Главными источниками оксидов серы (SO2 и SO3), обусловливающих образование серной кислоты, являются тепловые электростанции, работающие на нефти и угле, а также металлургические заводы. Оксид азота (NO) и диоксид азота (NO2), из которых образуется азотная кислота, поступают в атмосферу примерно в равных количествах от тепловых электростанций, работающих на нефтепродуктах и угле, и с выхлопными газами автомобильных двигателей.
Сравнительно небольшое количество соляной кислоты в атмосферных осадках образуется в результате аккумуляции газообразного хлора от различных природных и промышленных источников. Кислотные дожди могут также выпадать при поступлении в атмосферу серной кислоты и азотсодержащих газов (диоксида азота NO2 и аммиака NH3) от естественных источников (например, при извержении вулканов).
Последствия. Разные природные обстановки различным образом реагируют на повышение кислотности. Кислотные осадки могут привести к изменению химических свойств почвы и воды. Там, где вода в реках и озерах стала довольно кислой (рН менее 5), например, в горах Адирондак (шт. Нью-Йорк, США) или в южных районах Норвегии и Швеции, исчезает рыба. При нарушении трофических цепей сокращается число видов водных животных, водорослей и бактерий. В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур..
ЛИТЕРАТУРА
Израэль Ю.А., Назаров И.М., Прессман А.Я. и др. Кислотные дожди. Л., 1989 Хорват Л. Кислотный дождь. М., 1990
Энциклопедия Кольера. — Открытое общество. 2000, Сайт http://dic.academic.ru, Словари и энциклопедии на Академике
Кислотный дождь — все виды метеорологических осадков — дождь, снег, град, туман, дождь со снегом, при котором наблюдается понижение pH дождевых осадков из-за загрязнений воздуха кислотными оксидами (обычно — оксидами серы, оксидами азота).
История термина
Впервые термин «кислотный дождь» был введен в 1872 году английским исследователем Робертом Смитом. Его внимание привлек викторианский смог в Манчестере. И хотя ученые того времени отвергли теорию о существовании кислотных дождей, сегодня уже никто не сомневается, что кислотные дожди являются одной из причин гибели жизни в водоемах, лесов, урожаев, и растительности. Кроме того, кислотные дожди разрушают здания и памятники культуры, трубопроводы, приводят в негодность автомобили, понижают плодородие почв и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Вода обычного дождя тоже представляет собой слабокислый раствор. Это происходит вследствие того, что природные вещества атмосферы, такие как двуокись углерода (СО2), вступают в реакцию с дождевой водой. При этом образуется слабая угольная кислота (CO2 + H2O —> H2CO3). [2]. Тогда как в идеале рН дождевой воды равняется 5.6-5.7, в реальной жизни показатель кислотности (рН) дождевой воды в одной местности может отличаться от показателя кислотности дождевой воды в другой местности. Это, прежде всего, зависит от состава газов, содержащихся в атмосфере той или иной местности, таких как оксид серы и оксиды азота.
В 1883 году шведский ученый Сванте Аррениус ввел в обращение два термина — кислота и основание. Он назвал кислотами вещества, которые при растворении в воде образуют свободные положительно заряженные ионы водорода (Н+). Основаниями он назвал вещества, которые при растворении в воде образуют свободные отрицательно заряженные гидроксид-ионы (ОН-). Термин рН используют в качестве показателя кислотности воды. Термин рН значит в переводе с английского — показатель степени концентрации ионов водорода.
Химические реакции
Необходимо отметить, что даже нормальная дождевая вода имеет слабокислую (pH около 6) реакцию из-за наличия в воздухе диоксида углерода. Кислотный дождь образуется в результате реакции между водой и такими загрязняющими веществами, как оксид серы (SO2) и различными оксидами азота (NОх). Эти вещества выбрасываются в атмосферу автомобильным транспортом, в результате деятельности металлургических предприятий и электростанций.
Соединения серы (сульфиды, самородная сера и другие) содержатся в углях и рудах (особенно много сульфидов в бурых углях), при сжигании или обжиге которых образуются летучие соединения — оксид серы (IV) — SO2— сернистый ангидрид, оксид серы (VI) — SO3 — серный ангидрид, сероводород — H2S(в малых количествах, при недостаточном обжиге или неполном сгорании, при низкой температуре). Различные соединения азота содержатся в углях, и особенно в торфе (так как азот, как и сера, входит в состав биологических структур, из которых образовались эти полезные ископаемые).
При сжигании таких ископаемых образуются оксиды азота (кислотные оксиды, ангидриды) — например, оксид азота (IV) NO2.Вступая в реакцию с водой атмосферы (часто под воздействием солнечного излучения, так называемые «фотохимические реакции»), они превращаются в растворы кислот — серной, сернистой, азотистой и азотной. Затем, вместе со снегом или дождем, они выпадают на землю.
Экологические и экономические последствия
Последствия выпадения кислотных дождей наблюдаются в США, Германии, Чехии, Словакии, Нидерландах, Швейцарии, Австралии, республиках бывшей Югославии и ещё во многих странах земного шара. Кислотный дождь оказывает отрицательное воздействие на водоемы — озера, реки, заливы, пруды — повышая их кислотность до такого уровня, что в них погибает флора и фауна.
Выделяют три стадии воздействия кислотных дождей на водоемы. Первая стадия — начальная. С увеличением кислотности воды (показатели рН меньше 7) водяные растения начинают погибать, лишая других животных водоема пищи, уменьшается количество кислорода в воде, начинают бурно развиваться водоросли (буро-зеленые).
Первая стадия эутрофикации (заболачивания) водоема. При кислотности рН6 погибают пресноводные креветки.
Вторая стадия — кислотность повышается до рН5.5, погибают донные бактерии, которые разлагают органические вещества и листья, и органический мусор начинает скапливаться на дне. Затем гибнет планктон — крошечное животное, которое составляет основу пищевой цепи водоема и питается веществами, образующимися при разложении бактериями органических веществ.
Третья стадия — кислотность достигает рН 4.5, погибает вся рыба, большинство лягушек и насекомых. Первая и вторая стадии обратимы при прекращении воздействия кислотных дождей на водоем. По мере накопления органических веществ на дне водоемов из них начинают выщелачиваться токсичные металлы.
Повышенная кислотность воды способствует более высокой растворимости таких опасных металлов, как алюминий, кадмий, ртуть и свинец из донных отложений и почв. Эти токсичные металлы представляют опасность для здоровья человека. Люди, пьющие воду с высоким содержанием свинца или принимающие в пищу рыбу с высоким содержанием ртути, могут приобрести серьёзные заболевания. Кислотный дождь наносит вред не только водной флоре и фауне. Он также уничтожает растительность на суше. Ученые считают, что хотя до сегодняшнего дня механизм до конца ещё не изучен, «сложная смесь загрязняющих веществ, включающая кислотные осадки, озон, и тяжелые металлы в совокупности приводят к деградации лесов.
Экономические потери от кислотных дождей в США, по оценкам одного исследования, составляют ежегодно на восточном побережье 13 миллионов долларов и к концу века убытки достигнут 1.750 миллиардов долларов от потери лесов; 8.300 миллиардов долларов от потери урожаев (только в бассейне реки Огайо) и только в штате Минессота 40 миллионов долларов на медицинские расходы. Единственный способ изменить ситуацию к лучшему, по мнению многих специалистов,- это уменьшить количество вредных выбросов в атмосферу.
Википедия, сайт http://ru.wikipedia.org
КЛАССИФИКАЦИЯ ВОДОПОЛЬЗОВАНИЙ
- 1. По целям использования вод
1.1. Хозяйственно-питьевые нужды населения.
1.2. Коммунально-бытовые нужды населения.
1.3. Лечебные, курортные и оздоровительные цели.
1.4. Нужды сельскохозяйственного производства (без орошения).
1.5. Орошение.
1.6. Промышленные нужды.
1.7. Нужды гидроэнергетики.
1.8. Нужды водного транспорта и лесосплава.
1.9. Нужды рыбного хозяйства.
1.10. Сброс сточных вод.
1.11. Природоохранные нужды.
1.12. Санитарные попуски.
1.13. Многоцелевое водопользование.
1.14. Прочие нужды.
- 2. По объектам водопользования
2.1. Поверхностными водами суши.
2.2. Подземными водами.
2.3. Внутренними и территориальными морскими водами экономической зоны.
- 3. По техническим условиям водопользования
3.1. С применением сооружений и (или) технических устройств, влияющих на состояние водного объекта.
3.2. Без применения сооружений и (или) устройств.
- 4. По условиям предоставления водных объектов в пользование
4.1. Совместное.
4.2. Обособленное.
- 5. По характеру использования воды
5.1. Использование воды как вещества с определенными свойствами.
5.2. Использование массы и энергетического потенциала воды.
5.3. Использование воды как среды обитания.
- 6. По способу использования водных объектов
6.1. С изъятием воды и ее возвратом.
6.2. С изъятием воды без возврата.
6.3. Без изъятия воды.
- 7. По воздействию водопользований на водные объекты
7.1. На количественные характеристики водного объекта.
7.2. На качественные характеристики водного объекта.
7.3. На количественные и качественные характеристики водного объекта.
7.4. Без воздействия на количественные и качественные характеристики водного объекта.
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР ГОСТ17.1.1.03-86 ОХРАНА ПРИРОДЫ. ГИДРОСФЕРА КЛАССИФИКАЦИЯ ВОДОПОЛЬЗОВАНИЙ
Классификация вредных веществ
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности:
1-й — вещества чрезвычайно опасные;
2-й — вещества высокоопасные;
3-й — вещества умеренно опасные;
4-й — вещества малоопасные.
Класс опасности вредных веществ устанавливают в зависимости от норм и показателей, указанных в таблице.
| Наименование | Норма для класса опасности | |||
| показателя | 1-го | 2-го | 3-го | 4-го |
| Предельно допустимая концентрация (ПДК) вредных веществ в воздухе рабочей зоны, мг/куб.м |
Менее 0,1 |
0,1-1,0 |
1,1-10,0 |
Более 10,0 |
| Средняя смертельная доза при введении в желудок, мг/кг | Менее 15 | 15-150 | 151-5000 | Более 5000 |
| Средняя смертельная доза при нанесении на кожу, мг/кг | Менее 100 | 100-500 | 501-2500 | Более 2500 |
| Средняя смертельная концентрация в воздухе, мг/куб.м | Менее 500 | 500-5000 | 5001-50000 | Более 50000 |
| Коэффициент возможности ингаляционного отравления (КВИО) | Более 300 | 300-30 | 29-3 | Менее 3 |
| Зона острого действия | Менее 6,0 | 6,0-18,0 | 18,1-54,0 | Более 54,0 |
| Зона хронического действия | Более 10,0 | 10,0-5,0 | 4,9-2,5 | Менее 2,5 |
Отнесение вредного вещества к классу опасности производят по показателю, значение которого соответствует наиболее высокому классу опасности.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ ГОСТ 12.1.007-76 СИСТЕМА СТАНДАРТОВ БЕЗОПАСНОСТИ ТРУДА Вредные вещества Классификация и общие требования безопасности
Полностью Приложение к Словарю отходов смотрите здесь:
Словарь отходов смотрите здесь:
https://konsulmir.com/prilozhenie-k-slovaryu-otxodov-kategorii-otxodov-klassifikaciya-vrednyx-veshhestv/Книги, СловариПриложение к Словарю отходовПриложение к Словарю отходов Автор - составитель: Обухов Евгений Николаевич Категории отходов - Классификация вредных веществ Категории отходов Q I Отходы, образуемые в процессе производства или потребления, никакие другие из перечисленных ниже Q 2 Продукция, не отвечающая техническим условиям Q 3 Продукция, с истекшим сроком использования Q 4 Пролитые, рассыпанные, разбитые, испорченные или претерпевшие другие разрушения материалы,...konsulmir konsulmir@yandex.ruAdministratorОрганизации и консульства. Праздники, календари, выходные. Справочная информация. Анекдоты, юмор