Приложение к Словарю отходов Компостирование — Коррозия металлов
Приложение к Словарю отходов
Автор — составитель: Обухов Евгений Николаевич
Компостирование — Коррозия металлов
Компостирование
I Компостирование — способ обезвреживания бытовых, сельскохозяйственных и некоторых промышленных твердых отбросов, основанный на разложении органических веществ микроорганизмами. К. не подлежат больничные отбросы, субпродукты из ветлабораторий и отдельно фекалии. К компосту не допускаются примеси ядохимикатов, радиоактивных, дезинфицирующих и других токсических веществ, а также смолы и гудрона, в количествах, влияющих на процессы гумификации.
Обезвреживание отбросов при К. происходит в результате гибели большей части патогенных микроорганизмов (кроме споровых форм), яиц гельминтов и личинок мух под влиянием высокой температуры (не ниже 50°) и антагонистического воздействия микроорганизмов, а также вследствие разложения органического вещества отбросов и синтеза под влиянием биологических процессов нового органического вещества гумуса (перегноя), безвредного в санитарном отношении, являющегося хорошим удобрением.
Наиболее распространенным методом является К. в штабелях без предварительной обработки отбросов. При использовании этого метода обезвреживание достигается через 6—14 мес. Привозимые на поля компостирования отбросы формируют в штабеля в виде трапеций или в валы с шириной оснований 3—4 и 2—3 м, высотой 1,5—2 м (в северных районах высотой до 2,5 м) и длиной 10—25 м. Штабеля располагают параллельными рядами на расстоянии 3 м друг от друга. Для устранения запаха, сохранения тепла и предотвращения размножения мух поверхность штабелей покрывают слоем земли или торфа толщиной 15—20 см. Нижний слой компостной массы должен отстоять от уровня грунтовых вод не менее чем на 1 м.
Компост из твердых бытовых отходов применяется в качестве органического удобрения. Показателями его безопасности являются: влажность не выше 50—55%; отношение C: N — 20—25, pH — не менее 6,5—7,0; содержание органического вещества, азота, фосфора и калия — не менее 20%, 1%, 0,6%, 0,5% соответственно, коли-титр — 0,01—0,1 г. Посторонние включения в К. размером не более 20 мм не должны превышать 5%
Библиогр.: Коммунальная гигиена, под ред. К.М. Акулова и К.А. Буштуевой, с. 233, М., 1986; Руководство к лабораторным занятиям по коммунальной гигиене, под ред. Е.И. Гончарука, с. 237, М., 1982.
II Компостирование (англ. composting)
способ обезвреживания бытовых, сельскохозяйственных и некоторых промышленных отходов путем смешивания их с влагоемкими и газо-поглощающими материалами; в результате развития биотермических процессов происходит превращение этой смеси в сельскохозяйственное удобрение (компост).
Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.
Конвенция о запрещении разработки, производства и накопления запасов бактериологического (биологического) и токсинного оружия и об их уничтожении — открыта для подписания с 10 апреля 1972 г., вступила в силу 26 марта 1975 г. Участниками ее являются более 100 государств. Срок действия Конвенции не ограничен. Депозитариями Конвенции определены Россия (СССР), США и Великобритания.
Участники Конвенции взяли на себя обязательства:
-никогда не разрабатывать, не производить, не накапливать, не приобретать каким-либо иным образом, не сохранять микробиологические или другие биологические агенты или токсины (каково бы ни было их происхождение или метод производства) таких видов и в таких количествах, которые не имеют назначения для профилактических, защитных или других мирных целей, а также оружие, оборудование или средства доставки, предназначенные для использования таких агентов или токсинов во враждебных целях или в вооруженных конфликтах;
-уничтожить или переключить на мирные цели не позднее 9 месяцев после вступления в силу Конвенции все агенты, токсины, оружие, оборудование и средства доставки, которыми они обладают или которые находятся под юрисдикцией или контролем;
-не передавать другим государствам, не помогать им и не поощрять их к приобретению любых запрещаемых агентов, токсинов, оружия, оборудования или средств доставки.
Вместе с этим, участники Конвенции обязались способствовать обмену оборудованием, материалами, научной и технической информацией об использовании бактериологических (биологических) средств и токсинов в мирных целях. Конвенция явилась важным международным документом, запретившим дальнейшие работы по созданию опасных видов ОМП. На ее политической основе в 1985 г. была образована Австралийская группа, которая объединяет в настоящее время 32 государства, включая все промышленно развитые.
Группа представляет собой неформальную ассоциацию государств, в рамках которой разработаны принципы и методы взаимного контроля за торговлей химикатами, биологическими препаратами и соответствующими технологиями двойного назначения, а также определены формы обмена информацией об их экспорте в другие государства. Участники не берут на себя связывающих обязательств, решения Группы носят рекомендательный характер и принимаются на основе консенсуса.
Формирование Группы произошло после заключения специальной миссии ООН в Иране в 1984 г. о том, что в ирано-иракском конфликте применялось химическое оружие, которое создавалось с использованием западного сырья и технологий.
Цель Австралийской группы заключается в предотвращении распространения химического и биологического оружия посредством контроля за экспортом. В число участников Австралийской группы Россия не входит, однако придерживается ее правил и рекомендаций при осуществлении экспортного контроля.
Яндекс.Словари, Словарь «Война и мир в терминах и определениях», Сайт http://slovari.yandex.ru
Конвенция о запрещении разработки, производства, накопления и применения химического оружия и о его уничтожении — подписана 12-15 января 1993 г. в Париже полномочными представителями 130 государств мира. Конвенция подлежит ратификации подписавшими государствами согласно их соответствующим конституционным процедурам. Российская Федерация ратифицировала Конвенцию в 1997 г. Она вступила в силу 29 апреля 1998 г. Конвенция является бессрочной и открыта к подписанию для всех государств мира. Организация по запрещению химического оружия (ОЗХО) находится в Гааге (Нидерланды).
Государство-участник Конвенции принимает на себя обязательства никогда, ни при каких обстоятельствах:
-не разрабатывать, не производить, не приобретать иным образом, не накапливать или не сохранять химическое оружие или не передавать прямо или косвенно химическое оружие кому бы то ни было;
-не применять химическое оружие;
-не проводить любых военных приготовлений к применению химического оружия;
-не помогать, не поощрять или не побуждать каким-либо образом кого бы то ни было к проведению любой деятельности, запрещаемой государству-участнику по настоящей Конвенции;
-не использовать химические средства борьбы с беспорядками в качестве средства ведения войны.
Конвенция установила, что каждое государство-участник в соответствии со своими внутригосударственными процедурами принимает необходимые меры по выполнению своих обязательств по Конвенции и, в том числе:
-запрещает физическим и юридическим лицам, находящимся где бы то ни было на его территории или в любом другом месте под его юрисдикцией, как это признано международным правом, проводить любую деятельность, запрещаемую государству-участнику по настоящей Конвенции, в том числе применяет уголовное законодательство в отношении такой деятельности;
-не разрешает проводить в любом месте под его контролем любую деятельность, запрещаемую государству-участнику по настоящей Конвенции;
-распространяет свое уголовное законодательство на любую деятельность, запрещаемую государству-участнику по настоящей Конвенции, которая проводится где бы то ни было физическими лицами, обладающими его гражданством, в соответствии с международным правом.
Неотъемлемой частью Конвенции о запрещении химического оружия являются ее три приложения: по химикатам, по осуществлению и проверке, по защите конфиденциальной информации.
Яндекс.Словари, Словарь «Война и мир в терминах и определениях», Сайт http://slovari.yandex.ru
Конвенция о ядерной безопасности — принята в Вене 17 июня 1994 г. Конвенция утвердила следующие цели:
-стремиться к достижению высокого уровня ядерной безопасности во всем мире на основе укрепления национальных мер и международного сотрудничества, в том числе на основе технического сотрудничества в области безопасности, и поддерживать такой уровень;
-создавать и поддерживать на ядерных установках эффективные средства защиты от потенциальной радиационной опасности с тем, чтобы защитить отдельных лиц, общество в целом и окружающую среду от вредного воздействия ионизирующих излучений от таких установок;
-предотвращать аварии с радиологическими последствиями и смягчать такие последствия в том случае, если они произойдут.
Каждая Договаривающаяся Сторона создает и поддерживает законодательную и регулирующую основу для обеспечения безопасности ядерных установок.
Законодательная и регулирующая основа предусматривает:
-введение соответствующих национальных требований и регулирующих положений в области безопасности;
-введение системы лицензирования в отношении ядерных установок и запрещение эксплуатации ядерной установки без лицензии;
-введение системы регулирующего контроля и оценки ядерных установок для проверки соблюдения действующих регулирующих положений и условий лицензии;
-обеспечение выполнения действующих регулирующих положений и условий лицензии, включая приостановку действия, изменение или аннулирование.
Каждая Договаривающаяся Сторона учреждает или назначает регулирующий орган, которому поручается реализация законодательной и регулирующей основы и который наделяется надлежащими полномочиями, компетенцией, финансовыми и людскими ресурсами, необходимыми для выполнения порученных ему обязанностей.
Яндекс.Словари, Словарь «Война и мир в терминах и определениях», Сайт http://slovari.yandex.ru
Контейнеризация отходов
Выбор контейнеров зависит как от характера мусора (бытовые, домашние отходы; строительный мусор; макулатура, накапливающаяся в торговых точках), так и от местных традиций и плотности населения.
- При низкой плотности застройки (дома на одну семью) контейнеризация мусора неоправдана. Допустимо выносить мусор, упакованный в прочные пакеты, на обочину — непосредственно в пакетах, или в индивидуальных баках (малогабаритных контейнерах, в Европе — нормированных по DIN 30740 на ёмкость 80, 120, 140 л). Такие пакеты загружаются в приёмник мусоровоза с задней загрузкой вручную.
- В плотной городской застройке целесообразны контейнеры объёмом около 1 м³.
- Современные, так называемые евроконтейнеры имеют оцинкованный металлический бак со сдвигающейся крышкой, четыре колеса, а их форма позволяет использовать как машинную загрузку с использованием манипулятора, так и опрокидывание в приёмник мусоровоза вручную. Теоретический объём евроконтейнеров по EN 840-3 нормирован на 660, 770, 1000, 1100 л, при этом расчётная масса мусора в контейнере на 1000 л — не более 400 кг, а сам контейнер весит 67 кг.
- Традиционные советские контейнеры, ёмкостью 0.7 м³, имеют почти кубическую форму. Ранее широко применялись мусоровозы-контейнеровозы, вывозившие сами контейнеры, которые устанавливались манипулятором на плоскую платформу. В некоторых городах в советское время контейнеры не использовались. Вместо этого к определенному времени приезжал мусоровоз и жители близлежащих домов сами подходили и вываливали мусор в кузов. В современной России их полностью вытеснили мусоровозы, перевозящие только мусор, но не контейнеры — с задней загрузкой (вручную или с помощью гидравлического опрокидывателя), и с боковой загрузкой (с помощью гидравлического подъёмника-опрокидывателя).
- Для вывоза крупногабаритных отходов (строительный мусор, макулатура) используются открытые или закрытые бункеры (крупногабаритные контейнеры) вместимостью 5 м³ и выше. Их перевозят специальные самосвалы-бункеровозы с портальной загрузкой или мусоровозы типа «мультилифт». При нехватке средств муниципалитеты могут использовать промышленные контейнеры и для накопления обычных, бытовых, отходов.
- Для вывоза крупногабаритного неконтейнеризованного мусора, непригодного для ручной загрузки, применяются пары погрузчик-самосвал либо мусоровозы, оборудованные грейферным захватом.
- Мусоровозы различаются по объему кузова, а также по показателю массы загружаемых отходов. Объем кузова может варьировать от 6 до 20 кубометров, грузоподъемность начинается с двух тонн и доходит до максимальной грузоподъемности в 10 тонн. Мусоровозы, обладающие функцией прессования загружаемых в них отходов, имеют ещё такой показатель, как коэффициент уплотнения, который колеблется от 2,5 до 6 единиц. Мусоровозы на большегрузных шасси, как правило, отличаются бо́льшим коэффициентом уплотнения. При этом загрузка данных мусоровозов — автоматическая, при которой применяются сменные контейнеры повышенного объема.
- Существуют транспортные мусоровозы на шасси большегрузных прицепов и полуприцепов. Мусор в такие мусоровозы перегружается из обычных мусоровозов на расположенных в городской черте мусороперегрузочных станциях, после чего вывозится на удалённые полигоны. Объём кузова транспортных мусоровозов может доходить до 50 м³, а грузоподъёмность — до 25 тонн. Прессующий механизм уплотняет мусор в 5-6 раз.
Википедия, сайт http://ru.wikipedia.org
Коррозия (от позднелат. corrosio – разъедание; aнгл. corrosion):
1. Разрушение металлов вследствие хим. или электрохим. взаимодействия их c внешней (коррозионной) средой. B результате коррозии ежегодно теряется от 1 до 1,5% всего металла, накопленного и эксплуатируемого человечеством. Горное дело является одним из наиболее металлоёмких производств.
Особенность эксплуатации металлического оборудования определяется спецификой коррозионных условий применения (прокладка в грунтах и горных породах трубопроводов, обустройство эксплуатационных буровых скважин, повышенное содержание коррозионно-активных веществ в шахтах и на карьерах, эксплуатация морских платформ и другое). B cepедине 1980-x гг. ежегодные прямые потери по причине коррозии только нефтяной промышленности США превысили 1 млрд. долл.
Причина коррозии — термодинамич. неустойчивость системы, состоящей из металла и компонентов окружающей (коррозионной) среды. Коррозионные процессы классифицируют: по виду (геометрическому характеру) коррозионных разрушений на поверхности или в объёме металла; по механизму реакции взаимодействия металла co средой (химическая и электрохимическая коррозия); по типу коррозионной среды; по характеру дополнительных воздействий, которым подвергается металл одновременно c действием коррозионной среды.
Kоррозия, захватившая всю поверхность металла, называется сплошной. При местной коррозии поражения локальны и оставляют практически незатронутой значительную (иногда подавляющую) часть поверхности. B зависимости от степени локализации различают коррозионные пятна, язвы и точки (питтинг). Точечные поражения могут дать начало подповерхностной коррозии, распространяющейся в стороны под очень тонким (например, наклёпанным) слоем металла, который затем вздувается пузырями или шелушится.
Kоррозия является химической, если после разрыва металлич. связи атомы металла непосредственно соединяются химической связью c теми атомами или группами атомов, которые входят в состав окислителей, отнимающих валентные электроны металла. Химическая коррозия возможна в любой коррозионной среде, однако чаще всего она наблюдается в тех случаях, когда коррозионная среда не является электролитом (газовая коррозия, коррозия в неэлектропроводных органич. жидкостях).
Kоррозия. является электрохимической, если при выходе из металлич. решётки образующийся катион вступает в связь не c окислителем, a c др. компонентами коррозионной среды; окислителю же передаются электроны, освобождающиеся при образовании катиона. Такой процесс возможен в тех случаях, когда в окружающей среде существуют два типа реагентов, из к-рых одни (сольватирующие или комплексообразующие) способны соединяться устойчивыми связями c катионом металла без участия его валентных электронов, a другие (окислители) могут присоединять валентные электроны металла, не удерживая около себя катионы. Подобными свойствами обладают растворы или расплавы электролитов, где сольватированные катионы сохраняют значит. подвижность.
Некоторые коррозионные среды и вызываемые ими разрушения столь характерны, что по названию этих сред классифицируются и протекающие в них коррозионные процессы. Так, выделяют газовую коррозию, т. e, химическая коррозия под действием горячих газов (при температуpe много выше точки росы). Характерны некоторые случаи электрохимической коррозии (преимущественно c катодным восстановлением кислорода) в природных средах: атмосферная — в чистом или загрязнённом воздухе при влажности, достаточной для образования на поверхности металла плёнки электролита (особенно в присутствии агрессивных газов, напр. SO2, Cl2, или аэрозолей кислот, солей и т.п.); морская — под действием морской воды; подземная — в грунтах и почвах.
Kоррозия под напряжением развивается в зоне действия растягивающих или изгибающих механич. нагрузок, a также остаточных деформаций или термич. напряжений и, как правило, ведёт к транскристаллитному коррозионному растрескиванию, которому подвержены, например, стальные тросы и пружины в атмосферных условиях, углеродистые и нержавеющие стали в паросиловых установках, высокопрочные титановые сплавы в морской воде и т.д. При знакопеременных нагрузках может проявляться коррозионная усталость, выражающаяся в более или менее резком понижении предела усталости металла в присутствии коррозионной среды.
Коррозионная эрозия (или коррозия при трении) представляет собой ускоренный износ металла при одноврем. воздействии взаимно усиливающих друг друга коррозионных и абразивных факторов (трение скольжения, поток абразивных частиц и т.п.). Родственная ей кавитационная коррозия возникает при кавитац. режимах обтекания металла агрессивной средой, когда непрерывное возникновение и «захлопывание» мелких вакуумных пузырьков создаёт поток разрушающих микрогидравлич. ударов, воздействующих на поверхность металла.
Утечка электрич. тока через границу металла c агрессивной средой вызывает в зависимости от характера и направления утечки дополнит. анодные и катодные реакции, могущие прямо или косвенно вести к ускоренному местному или общему разрушению металла (коррозия блуждающим током). Сходные разрушения, локализуемые вблизи контакта, могут вызвать соприкосновение в электролите двух разнообразных металлов, образующих замкнутый гальванич. элемент, — контактная коррозия.
B узких зазорах между деталями, a также под отставшим покрытием или наростом, куда проникает электролит, но затруднён доступ кислорода, необходимого для пассивации металла, может развиваться щелевая коррозия, при которой растворение металла в основном происходит в щели, a катодные реакции частично или полностью протекают рядом c ней на открытой поверхности.
Скорость общей коррозии оценивают по убыли металла c единицы площади, напр. в г/м2·ч, или по скорости проникновения коррозии, т.e. по одностороннему уменьшению толщины нетронутого металла, напр. в мм/год.
Среди горного оборудования коррозия в наибольшей степени подвержены трубопроводы, буровые платформы, промысловое оборудование, шахтные и карьерные машины и др. Наивысшая скорость коррозии трубопроводов и буровых платформ наблюдается на мор. объектах в зоне т.н. переменного смачивания (на уровне ок. 0,85 м выше уровня моря).
Кроме того, электрохим. коррозия наблюдается y элементов этих конструкций, заглублённых в грунт. Коррозия, вызываемая блуждающими токами, характеризуется скоростью до 10 мм/год. Разрушение металлического оборудования нефтяных и газовых промыслов происходит под комплексным воздействием содержащихся в сырой нефти и неочищенном природном газе агрессивных компонентов, почвогрунта, внеш. электрич. полей и атмосферы.
При коррозии корродируют обсадные и насосно-компрессорные трубы, фонтанная и запорная арматура, промысловые трубопроводы и сепараторы, теплообменники, резервуарные парки и др. Антикоррозионная защита горного оборудования осуществляется c помощью изоляционных покрытий, ингибиторов коррозии, электрохимической поляризации и др.
E. Легезин, H. П. Глазов;
2. Разрушение (растворение) горн. пород под влиянием хим. воздействия воды c образованием трещин, каналов, воронок, котловин, каверн, пещер и др. пустот и углублений; особенно наглядно проявляется в местах развития легкорастворимых пород (кам. соли, гипса, известняков и др.);
3. Разъедание и частичное растворение магматич. расплавом или лавой кристаллов-вкрапленников, выделившихся на первом этапе их кристаллизации, или обломков пород (ксенолитов), захваченных магмой при её внедрении.
Горная энциклопедия. — М.: Советская энциклопедия. Под редакцией Е. А. Козловского. 1984—1991, Сайт http://dic.academic.ru, Словари и энциклопедии на Академике
Коррозия металлов — самопроизвольное физико-химическое разрушение и превращение полезного металла в бесполезные химические соединения. Большинство компонентов окружающей среды, будь то жидкости или газы, способствуют коррозии металлов; постоянные природные воздействия вызывают ржавление стальных конструкций, порчу корпусов автомобилей, образование питтингов (ямок травления) на хромированных покрытиях и т.д.
В этих примерах поверхность металла видимым образом разрушается, но понятие коррозии включает случаи внутреннего разрушительного воздействия, например на границе между кристаллами металла. Эта так называемая структурная (межкристаллитная) коррозия протекает внешне незаметно, но может приводить к авариям и даже несчастным случаям. Зачастую неожиданные повреждения металлических деталей связаны с напряжениями, в частности, связанными с коррозионной усталостью металла.
Не всегда коррозия имеет деструктивный характер. Например, зеленая патина, часто наблюдаемая на бронзовых скульптурах, является оксидом меди, который эффективно защищает металл под оксидной пленкой от дальнейшей атмосферной коррозии. Этим объясняется прекрасное состояние многих старинных бронзовых и медных монет. Борьба с коррозией проводится методами защиты, разработанными на основе хорошо известных научных принципов, однако она остается одной из самых серьезных и сложных задач современной техники. Около 20% общего количества металлов ежегодно теряется из-за коррозии, и огромные средства тратятся на защиту от коррозии.
Электрохимическая природа коррозии. М. Фарадеем (1830-1840) была установлена связь между химическими реакциями и электрическим током, что явилось основой электрохимической теории коррозии. Однако детальное понимание коррозионных процессов пришло только в начале 20 в. Электрохимия как наука возникла в 18 в. благодаря изобретению А.Вольта (1799) первого гальванического элемента (вольтов столб), с помощью которого был получен непрерывный ток за счет преобразования химической энергии в электрическую.
Гальванический элемент состоит из одной электрохимической ячейки, в которой два различных металла (электроды) частично погружены в водный раствор (электролит), способный проводить электричество. Электроды вне электролита соединяются электрическим проводником (металлической проволочкой). Один электрод («анод») растворяется (корродирует) в электролите, образуя ионы металла, которые переходят в раствор, в то время как ионы водорода накапливаются на другом электроде («катоде»). Поток положительных ионов в электролите компенсируется посредством прохождения тока электронов (электрического тока) от анода к катоду во внешней цепи.
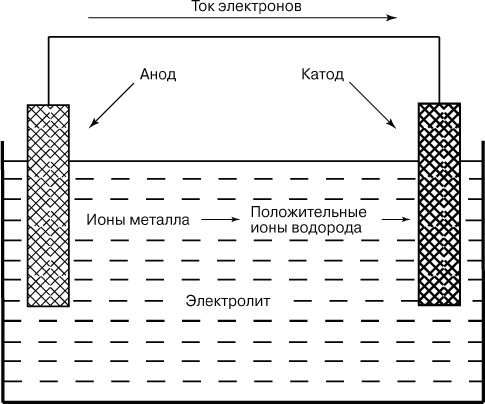
СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА иллюстрирует принцип естественного процесса коррозии металла.
Ионы металла, переходя в раствор, реагируют с компонентами раствора, давая продукты коррозии. Эти продукты зачастую растворимы и не препятствуют дальнейшей коррозии металлического анода. Так, если две смежные области, например на поверхности стали, хотя бы слабо отличаются друг от друга по составу или структуре, то в подходящей (например, влажной) среде на этом месте образуется коррозионная ячейка. Одна область является анодом по отношению к другой, и именно она будет корродировать.
Таким образом, все малые локальные неоднородности металла образуют анодно-катодные микроячейки, по этой причине металлическая поверхность содержит многочисленные участки, потенциально подверженные коррозии. Если сталь опустить в обычную воду или почти любую водосодержащую жидкость, то уже готов подходящий электролит. Даже в умеренно влажной атмосфере на поверхности металла будет оседать конденсат влаги, приводящий к возникновению электрохимической ячейки.
Как уже отмечалось, электрохимическая ячейка состоит из электродов, погруженных в электролит (т.е. из двух полуячеек). Потенциал (электродвижущая сила, ЭДС) электрохимической ячейки равен разности потенциалов электродов обеих полуячеек. Потенциалы электродов измеряются относительно водородного электрода сравнения. Измеренные электродные потенциалы металлов сведены в ряд напряжений, в котором благородные металлы (золото, платина, серебро и др.) находятся на правом конце ряда и имеют положительное значение потенциала.
Обычные, неблагородные, металлы (магний, алюминий и т.д.) имеют сильно отрицательные потенциалы и располагаются ближе к началу ряда слева от водорода. Положение металла в ряду напряжений указывает на его устойчивость к коррозии, которая возрастает от начала ряда к его концу, т.е. слева направо..
Поляризация. Движение положительных (водородных) ионов в электролите по направлению к катоду с последующим разрядом приводит к образованию молекулярного водорода на катоде, что изменяет потенциал данного электрода: устанавливается обратный по знаку (стационарный) потенциал, который уменьшает общее напряжение ячейки.
Ток в ячейке очень быстро спадает до чрезвычайно малых величин; в этом случае говорят, что ячейка «поляризована». Это состояние предполагает уменьшение или даже прекращение коррозии. Однако взаимодействие растворенного в электролите кислорода с водородом может свести на нет подобный эффект, поэтому кислород называют «деполяризатором». Эффект поляризации иногда проявляется в уменьшении скорости коррозии в стоячих водах вследствие недостатка кислорода, хотя такие случаи нетипичны, поскольку эффекты конвекции в жидкой среде обычно достаточны для подвода растворенного кислорода к поверхности катода.
Неравномерное распределение деполяризатора (как правило, это кислород) над поверхностью металла тоже может вызывать коррозию, поскольку при этом образуется кислородная концентрационная ячейка, в которой коррозия происходит таким же образом, как в любой электрохимической ячейке.
Пассивность и другие анодные эффекты. Термин «пассивность» (пассивирование) был первоначально использован по отношению к коррозионной стойкости железа, погруженного в концентрированный раствор азотной кислоты. Однако это более общее явление, так как в определенных условиях многие металлы находятся в пассивном состоянии.
Феномен пассивности был объяснен в 1836 Фарадеем, который показал, что ее причиной является чрезвычайно тонкая оксидная пленка, образующаяся в результате химических реакций на поверхности металла. Такая пленка может восстанавливаться (изменяться химически), и металл вновь становится активным при контакте с металлом, имеющим более отрицательный потенциал, например, железо в соседстве с цинком. При этом образуется гальваническая пара, в которой пассивный металл является катодом.
Водород, выделяющийся на катоде, восстанавливает его защитную оксидную пленку. Оксидные пленки на алюминии защищают его от коррозии, и потому анодированный алюминий, получающийся в результате анодного окислительного процесса, используется как в декоративных целях, так и в быту. В широком химическом смысле все анодные процессы, протекающие на металле, являются окислительными, однако термин «анодное окисление» подразумевает целенаправленное образование значительного количества твердого оксида.
Пленка определенной толщины образуется на алюминии, являющемся анодом в ячейке, электролитом которой служит серная или фосфорная кислота. Во многих патентах описаны различные модификации этого процесса. Первоначально анодированная поверхность имеет пористую структуру и может быть окрашена в любой желаемый цвет. Введение в электролит бихромата калия дает яркий оранжево-желтый оттенок, в то время как гексацианоферрат(II) калия, перманганат свинца и сульфид кобальта окрашивают пленки в голубой, красно-коричневый и черный цвета соответственно.
Во многих случаях применяются водорастворимые органические красители, и это придает металлический глянец окрашенной поверхности. Образующийся слой необходимо закрепить, для чего достаточно обработать поверхность кипящей водой, хотя используются и кипящие растворы ацетатов никеля или кобальта.
Структурная (межкристаллитная) коррозия. Различные сплавы, в частности алюминиевые, увеличивают свою твердость и прочность при старении; процесс ускоряют, подвергая сплав термообработке. При этом образуются субмикроскопические частицы, которые располагаются вдоль пограничных слоев микрокристаллов (в межкристаллитном пространстве) сплава.
В определенных условиях область, непосредственно примыкающая к границе, становится анодом по отношению к внутренней части кристалла, и в коррозионной среде границы между кристаллитами будут преимущественно подвержены коррозии, причем коррозионные трещины глубоко внедряются в структуру металла. Эта «структурная коррозия» серьезно влияет на механические свойства. Ее можно предотвратить либо с помощью правильно подобранных режимов термообработки, либо защитой металла непроницаемым для коррозии покрытием.
Плакирование — холодное покрытие одного металла другим: высокопрочный сплав прокатывается между тонкими полосками чистого алюминия и уплотняется. Металл, входящий в подобную композицию, становится коррозионностойким, при этом само покрытие слабо сказывается на механических свойствах.
Предотвращение коррозии. При электрохимической коррозии образующиеся продукты часто растворяются (переходят в раствор) и не препятствуют дальнейшему разрушению металла; в некоторых случаях в раствор можно добавить химическое соединение (ингибитор), которое реагирует с первичными продуктами коррозии с образованием нерастворимых и обладающих протекторными свойствами соединений, которые осаждаются на аноде или на катоде.
Например, железо легко корродирует в разбавленном растворе обычной соли (NaCl), однако при добавлении сульфата цинка в раствор образуется малорастворимый гидроксид цинка на катоде, а при добавлении фосфата натрия — нерастворимый фосфат железа на аноде (примеры катодных и анодных ингибиторов соответственно). Такие методы защиты можно применять только в тех случаях, когда конструкция целиком или частично погружена в жидкую коррозионную среду.
Для уменьшения скорости коррозии часто используют катодную защиту. В этом методе на систему накладывается электрическое напряжение таким образом, чтобы вся защищаемая конструкция была катодом. Это осуществляется подключением конструкции к одному полюсу выпрямителя или генератора постоянного тока, в то время как к другому полюсу подключается внешний химически инертный анод, такой, как графит. Например, в случае защиты от коррозии трубопроводов нерастворимый анод зарывается в землю вблизи от них.
В некоторых случаях для этих целей используются дополнительные защитные аноды, например, подвешенные внутри емкостей для хранения воды, причем вода в емкости выполняет роль электролита. В других методах катодной защиты обеспечивается достаточный ток, протекающий от какого-либо иного источника через конструкцию, которая полностью становится катодом и содержит возможные локальные аноды и катоды при одном и том же потенциале. Для этого к защищаемому металлу подсоединяют металл с более отрицательным потенциалом, который в образуемой гальванической паре играет роль протекторного анода и разрушается первым.
Протекторные аноды из цинка применялись уже с 1825, когда знаменитый английский химик Х.Дэви предложил использовать их для защиты медной обшивки деревянных корпусов кораблей. Аноды на основе магниевых сплавов широко используются для защиты корпусов современных кораблей от коррозии в морской воде. Протекторные аноды чаще применяются по сравнению с анодами, связанными с внешними источниками тока, поскольку они не требуют энергозатрат. Окрашивание поверхности также используется для защиты от коррозии, особенно если конструкция не полностью погружена в жидкость. Металлические покрытия можно наносить путем напыления металлов или при помощи гальванотехники (например, хромирование, цинкование, никелирование).
Типы специфической коррозии. Коррозия в напряженном состоянии представляет собой разрушение металла под влиянием комбинированного действия статической нагрузки и коррозии. Основной механизм — первоначальное образование коррозионных питтингов и трещин с последующим разрушением конструкции, вызванным концентрациями напряжения в этих трещинах. Детали механизма коррозии сложны и не всегда понятны, они могут быть связаны с остаточными напряжениями.
Чистые металлы, а также латунь не склонны к коррозии в напряженном состоянии. В случае сплавов появляются трещины в межкристаллитном пространстве, которое является анодом по отношению к внутренним участкам зерен; это увеличивает вероятность коррозионного воздействия вдоль межкристаллитных границ и облегчает последующий процесс растрескивания по ним. Коррозионная усталость также является следствием совместного действия механического напряжения и коррозии.
Однако циклические нагрузки опаснее статических. Усталостное растрескивание часто наступает и в отсутствие коррозии, но разрушительный эффект коррозионных трещин, которые создают места концентрации напряжения, очевиден. Вероятно, все так называемые усталостные механизмы включают коррозию, так как невозможно полностью исключить поверхностную коррозию. Коррозия под действием жидких металлов — особая форма коррозии, которая не включает электрохимический механизм. Жидкие металлы имеют большое значение в системах охлаждения, в частности, ядерных реакторов.
В качестве охладителей используются жидкие калий и натрий и их сплавы, а также жидкие свинец, висмут и свинцово-висмутовые сплавы. Большинство конструкционных металлов и сплавов при контакте с подобной жидкой средой в той или иной степени подвергаются деструкции, при этом механизм коррозии в каждом случае может быть различным.
Во-первых, материал контейнера или труб в системе теплопередачи может в небольшой степени растворяться в жидком металле, а так как растворимость обычно изменяется с температурой, растворенный металл может осаждаться из раствора в охлажденной части системы, забивая при этом каналы и клапаны.
Во-вторых, возможно межкристаллитное проникновение жидкого металла, если существует его селективная реакция с легирующими добавками конструкционного материала. Здесь, как и в случае электрохимической межкристаллитной коррозии, механические свойства ухудшаются без видимых проявлений и без изменения массы конструкции; правда, такие случаи разрушительного воздействия встречаются редко.
В-третьих, жидкий и твердый металлы могут взаимодействовать с образованием поверхностного сплава, который в некоторых случаях служит диффузионным барьером по отношению к дальнейшему воздействию. Эрозионная коррозия (ударная, кавитационная коррозия) относится к механическому воздействию жидкого металла, текущего в турбулентном режиме. В экстремальных случаях это приводит к кавитации и эрозионному разрушению конструкции.
Коррозионные эффекты радиации интенсивно исследуются в связи с развитием атомной энергетики, однако в открытой печати мало информации по этому вопросу. Общеупотребительный термин «радиационное повреждение» относится ко всем изменениям механической, физической или химической природы твердых материалов, которые обусловлены воздействием радиации следующих типов: ионизирующее излучение (рентгеновское или g), легкие заряженные частицы (электроны), тяжелые заряженные частицы (a-частицы) и тяжелые незаряженные частицы (нейтроны).
Известно, что бомбардировка металла тяжелыми частицами высоких энергий приводит к возникновению нарушений на атомном уровне, которые при соответствующих обстоятельствах могут быть местами возникновения электрохимических реакций. Однако более важное изменение происходит не в самом металле, а в его окружении. Такие непрямые эффекты возникают в результате действия ионизирующего излучения (например, g-лучей), которое не изменяет свойства металла, но в водных растворах вызывает образование высокореакционных свободных радикалов и пероксида водорода, а подобные соединения способствуют возрастанию скорости коррозии.
Кроме того, такой ингибитор коррозии, как дихромат натрия, будет восстанавливаться и терять свою эффективность. Под действием ионизирующего излучения оксидные пленки также ионизируются и теряют свои коррозионнозащитные свойства. Все вышеперечисленные особенности сильно зависят от конкретных условий, связанных с коррозией.
Окисление металлов. Большинство металлов взаимодействует с кислородом воздуха с образованием стабильных оксидов металла. Скорость, с которой происходит окисление, сильно зависит от температуры, и при нормальной температуре на металлической поверхности образуется только тонкая пленка оксида (на меди, например, это заметно по потемнению поверхности). При более высоких температурах процесс окисления протекает быстрее.
Благородные металлы представляют исключение из этого правила, так как обладают малым сродством к кислороду. Предполагается, что золото вообще не окисляется при нагревании на воздухе или в кислороде, а слабое окисление платины при температурах до 450° С прекращается при нагревании до более высоких температур. Обычные же конструкционные металлы окисляются с образованием четырех типов оксидных соединений: летучих, плотных, защитных или непористых.
Небольшое число тугоплавких металлов, таких, как вольфрам и молибден, становятся хрупкими при высоких температурах и образуют летучие оксиды, поэтому защитный оксидный слой не образуется и при высокой температуре металлы следует защищать инертной атмосферой (инертные газы).
Сверхлегкие металлы образуют, как правило, слишком плотные оксиды, которые пористы и не защищают металлы от дальнейшего окисления. По этой причине магний окисляется очень легко. Защитные оксидные слои образуются у многих металлов, но обычно они обладают умеренной защитной способностью. Оксидная пленка на алюминии, например, полностью покрывает металл, однако при напряжениях сжатия развиваются трещины, по-видимому, за счет изменений температуры и влажности.
Защитный эффект оксидных слоев ограничивается относительно низкими температурами. Многие «тяжелые металлы» (например, медь, железо, никель) образуют непористые оксиды, которые, хотя и не растрескиваются, не всегда защищают основной металл. Теоретически эти оксиды представляют большой интерес и активно исследуются. Они содержат менее стехиометрического количества металла; отсутствующие атомы металла образуют дырки в решетке оксида. Вследствие этого атомы могут диффундировать сквозь решетку, и толщина оксидного слоя постоянно увеличивается.
Применение сплавов. Так как все известные конструкционные металлы склонны к окислению, элементы конструкции, которые находятся при высоких температурах в окислительной среде, следует изготовлять из сплавов, которые в качестве легирующего элемента содержат металл, стойкий к действию окислителя. Этим требованиям отвечает хром — достаточно дешевый металл (применяемый в виде феррохрома), который присутствует в составе почти всех высокотемпературных сплавов, отвечающих требованиям устойчивости к окислению.
Поэтому все нержавеющие стали, легированные хромом, имеют хорошую устойчивость к окислению и находят широкое применение в домашнем хозяйстве и промышленности. Сплав нихром, который повсеместно применяется в качестве проволоки для спиралей электрических печей, содержит 80% никеля и 20% хрома и вполне стоек к окислению при температурах до 1000° С.
Не меньше, чем устойчивость к окислению, важны механические свойства, и часто оказывается, что определенные элементы сплавов (такие, как хром) придают сплаву и высокотемпературную прочность, и устойчивость к окислению, так что проблема высокотемпературного окисления не вносила серьезных затруднений до тех пор, пока не стали использовать (в газотурбинных двигателях) в качестве топлива мазут, содержащий ванадий или натрий. Эти загрязнения вместе с серой в топливе дают продукты сгорания, обладающие чрезвычайно сильным коррозионным действием.
Попытки решить эту проблему завершились разработкой добавок, которые при сгорании образуют безопасные летучие соединения с ванадием и натрием. Фреттинг-коррозия не включает в себя электрохимическую коррозию или прямое окисление в газовой фазе, а является в основном механическим эффектом. Это повреждение сочленных металлических поверхностей в результате истирания при их малых многократных относительных смещениях; наблюдается в виде царапин, язв, раковин; сопровождается заклиниванием и снижает устойчивость к коррозионной усталости, т.к. образующиеся царапины служат исходными точками для развития коррозионной усталости.
Типичные примеры — повреждения в пазах крепления лопаток турбин при вибрации, истирание рабочих колес компрессора, изнашивание зубьев шестеренок, резьбовых соединений и т.д. При малых многократных смещениях защитные оксидные пленки разрушаются, истираются в порошок и увеличивается скорость коррозии. Фреттинг-коррозия стали легко идентифицируется по наличию красно-коричневых частиц оксида. Борьбу с фреттинг-коррозией ведут путем совершенствования конструкций, применения защитных покрытий, эластомерных прокладок, смазок..
Литература
Кеше Г. Коррозия металлов. М., 1984 Колотыркин Я.М. Металл и коррозия. М., 1985 Люблинский Е.Я. Что нужно знать о коррозии. Л., 1986 Фомин Г.С. Коррозия и защита от коррозии. Энциклопедия международных стандартов. М., 1994
Энциклопедия Кольера. — Открытое общество. 2000, Сайт http://dic.academic.ru, Словари и энциклопедии на Академике
Коррозия металлов (от позднелат. corrosio — разъедание) — физико-химическое взаимодействие металлического материала и среды, приводящее к ухудшению эксплуатационных свойствв материала, среды или технмческой системы, частями которой они являются. В основе коррозии металлов лежит химическая реакция между материалом и средой или между их компонентами, протекающая на границе раздела фаз. Чаще всего это — окисление металла, например
3Fe+2О 2=Fe3O4; Fe+H2SO4=FeSO4+Н 2
По стехиометрии такие реакции довольно просты, но по механизму они относятся к наиболее сложным гетерогенным реакциям. Иногда при коррозии металлов происходит и восстановление некоторых компонентов материала; например, при высоких давлениях и т-рах карбиды восстанавливаются в стали проникающим водородом. К коррозии металлов нередко относят также некоторые случаи их растворения в жидких металлах (напр., растворение сталей в жидкометаллич. теплоносителях ядерных реакторов).
Коррозия металлов — самопроизвольный процесс, сопровождающийся уменьшением энергии Гиббса системы конструкц. материал — среда. Для реакций коррозии металлов изменения энергии Гиббса по порядку величины таковы же, как и для самопроизвольно протекающих химических реакций. Термодинамическая нестабильность системы конструкц. металл — среда является причиной широкой распространенности коррозии металлов во всех отраслях техники.
Нормальная эксплуатация оборудования, коммуникаций, транспортных средств и т. п. часто возможна лишь при достаточном замедлении коррозии металлов, достигаемом при помощи многообразных способов и средств защиты от коррозии. Изменением состава материала или среды или созданием особых условий можно добиться того, что коррозияи металлов самотормозится из-за образования поверхностных защитных слоев. На нек-рых металлах (Al, Ti и др.) защитные слои в ряде сред образуются и без специальных мер.
Несмотря на успехи в борьбе с коррозией металлов, ее проблемы обостряются из-за непрерывного роста металлического фонда и ужесточения условий эксплуатации металлов. Это связано с использованием высокоагрессивных сред (химическая промышленность, ядерная и геотермальная области энергетики, разработка шельфа и др.), повышением рабочих температур, давления и скоростей потоков, загрязнением атмосферы SO, и др. примесями и т. п.
Новые конструкционные материалы нередко подвергаются малоизученным и трудно прогнозируемым коррозионным разрушениям. Повышаются экологические требования к средствам и технологиям защиты от коррозии; становится менее доступным сырье для производства ряда коpрозионностойких материалов. В итоге возрастают как безвозвратные потери металла, стоимость которых входит в прямые убытки от коррозии металлов, так и затраты на защиту от коррозии.
Однако наиболее велики косвенные убытки от коррозии металлов, связанные с простоями и снижением фондоотдачи, потерями и ухудшением качества продукции, авариями и т. п. В сумме косвенные и прямые убытки от коррозии металлов и затраты на защиту (в соотношении примерно (3-4):1:1) в промышленно развитых странах достигают 4% национального дохода и более.
Механизм коррозии металлов определяется прежде всего типом агрессивной среды. В сухих окислит. газах при повыш. температурах на поверхности большинства конструкц. металлов образуется слой твердых продуктов коррозии (окалина). При условии сплошности этого слоя скорость коррозии металлов чаще всего лимитируется диффузией через него ионов металла к границе слой — газ или окислителя (напр., О 2-) к границе слой-металл.
Иной механизм имеет очень распространенная коррозии металлов в электролитических средах — растворах электролитов (в т. ч. в виде тонких пленок на пов-сти металла), пропитанных электролитами пористых и капиллярно-пористых телах (почвы, бетоны, некоторые изоляц. материалы, рыхлые отложения и др.), а также в расплавах электролитов. В таких средах суммарный процесс коррозии металлов можно записать в виде р-ции:
М+Ох=М z++Red, (1)
где М — металл. Ох — частица окислителя. Red — его восстановльная форма (Ох имеет заряд +ze или Red — заряд -zе); здесь для упрощения принято равенство всех стехиометрич. коэффициентов. В преобладающем большинстве случаев реакция (1) протекает по так называемому электрохимическому механизму: атом М и частица Ох непосредственно не контактируют, передача электронов от М к Ох происходит через зону проводимости М (рис. 1,а).
Таким образом, процесс (1) фактически состоит из двух р-ций: анодного растворения металла и катодного восстановления окислителя:
М=Mz++ze, (la) Ох+ze = Red. (16)
Скорость каждой из реакций может быть определена соответствующим кинетическим уравнением и в этом смысле они полностью независимы, но при совместном протекании реакции связаны условием электронейтральности системы. В некоторых случаях возможно влияние продуктов одной реакции на скорость другой.
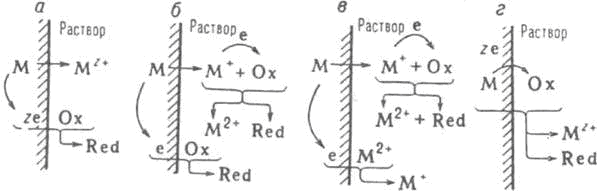
Рис. 1. Механизмы коррозии металлов: электрохимический (а); электрохимическо-химический (6); каталитический (в); предполагаемый химический (г). Для механизмов «6» и «в» принято зарядовое число z=2.
В электролитической среде с высокой электрич. проводимостью (металлическую поверхность можно рассматривать как эквипотенциальную, т. е. имеющую одинаковый во всех точках электродный потенциал Е. Последний при стационарном протекании электрохим. коррозии металлов принимает, как правило, определенное значение E кор, при к-ром одинаковы скорости анодной и катодной р-ций, обычно выражаемые в единицах плотности тока и обозначаемые ia и i к соответственно.
Потенциал E кoр наз. потенциалом коррозии или стационарным потенциалом; соответствующая ему величина плотности тока
ia=i к=i кор (2)
называемой скоростью или током коррозии. Коррозия металлов всегда необратимый процесс, поэтому значение E кор не может быть определено на основании термодинамич. соотношений и вычисляется только из кинетических уравнений реакций (1а) и (16).
В общем случае значения ia и i к зависят от потенциала E экспоненциально; эти зависимости в упрощенной записи имеют вид:
i а=k а ехр(2,303Е/ba), (За) i к=k кcOxeхр(-2,З0ЗЕ/b к), (3б)
где cOx — концентрация окислителя Ох; ka и k к — эмпирически постоянные при данной температуре, которые, однако, могут зависеть от состава среды (k к не зависит от с 0х); ba и b к — постоянные Тафеля для анодной и катодной реакций соответственно. В координатах E-lgi зависимости (За) и (36) изображаются прямыми линиями (рис. 2, А). точке пересечения которых отвечают величины Е кор и i кор. При этом из (За) и (36) следует:
![]()
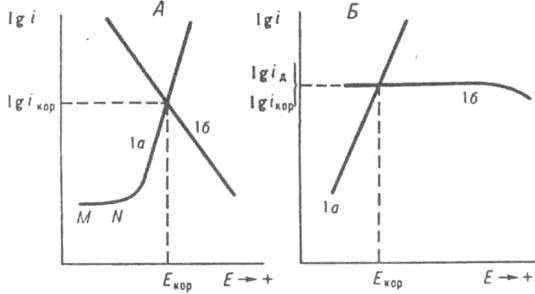
Рис. 2. Зависимость скорости i анодного растворения металла (l a) и катодного восстановления окислителя (1б) от электродного потенциала Е при элсюрохпм механизме коррозии. А- катодный процесс протекает в истино кинeтческом режиме. Б в режиме предельного диффузионного тока. i кор и E кор значения тока и потенциала коррозии соотв.. i д — предельный диффузионный ток.
Уравнения (За) и (36) отражают, в частности, кинетику типичной для неокислительных кислых сред электрохимическую коррозию металлов с восстановлением. Н + — ионов; в водных растворах реакция (16) имеет вид: 2Н 3 О ++2е=Н 2+2Н 2 О. Если для анодной реакции выполняется уравнение (За), а скорость катодной реакции полностью определяется диффузионным подводом Ох к поверхности М, то величина i к максимальна в режиме предельного диффузионного тока i д (рис. 2, Б); в этом случае ik=i д=i кор и E кop=balg(i дka-1). (5) Соотношение (5) характерно для распространенной в нейтральных и некоторых др. средах электрохим. коррозии с восстановлением растворенного кислорода, в водных растворах р-ция (16) имеет вид:
О 2+2Н 2 О+4е=4ОН —.
В большинстве случаев распределение на поверхности металла точек мгновенного протекания реакций (1а) и (1б) изменяется во времени статистически беспорядочно; соотвенно средняя по времени скорость анодной реакции (а значит. и скорость коррозии металлов) в любой точке поверхности одинакова и совпадает со скоростью катодной реакции (равномерная или сплошная коррозия металлов).
Гетерогенность металла или среды, различные условия подвода окислителя или отвода продуктов коррозии, не нарушая эквипотенциальноети поверхности (при высоких значениях (), могут приводить к возникновению на ней участков устойчивого предпочтительного протекания одной из реакций — (1а) или (16), в соответствии с локальными значениями k а и ba, k к, b к и с Oх (или i д). Для таких участков уже не выполняется равенство (2), т. с. ia№ik, а в предельном случае на одних участках со скоростью i а протекает практически только анодная реакция, на других, со скоростью i к, — только катодная.
Требование электронейтральности системы приводит к условию: iaSSa=i кSS к, где SS. и SS к — суммарные площади «анодных» и «катодных» участков соответственно. Чем больше значения i к и SS к/SSa, тем интенсивнее локальное растворение металла на анодных участках (в отсутствие пассивации). При возрастании такой предпочтит. локализации, как правило, возрастает опасность локальных коррозионных разрушений, которая в реальных условиях чаще всего превосходит опасность для системы равномерной коррозии металлов.
Причины описанной локальной коррозии металлов многообразны: различия в составе зерна металла в объеме и на границе, концентрациях механических напряжений, микровключения, разная природа контактирующих металлов, диффузионная неравнодоступность участков поверхности и др. Участки поверхности металла, на которых наблюдаются повышенные значения i а, м. б. макро- или микроскопическими.
Первые наблюдаются обычно при контактной коррозии в месте соединения разнородных металлов, при щелевой коррозии (внутрищелевая поверхность — анод, открытая — катод), на поздних стадиях питтинговой коррозии (питтинги в виде крупных язв); вторые — при межкристаллитной коррозии и на ранних стадиях питтинговой коррозии. Рост коррозионных трещин в ряде случаев объясняют тем, что анодный процесс локализуется в вершине (острие) трещин.
В электролитической среде с малой электрической проводимостью (за счет неоднородности металла или среды протяженная металлическая поверхность может быть неэквипотенциальной, т. е. для такой пов-сти характерно не одно значение E кор, а некоторое распределение потенциала. За исключением простейших по своей геометрии систем, теоретическое построение распределений потенциала и токов i а и i к при постоянстве (требует решения дифференциального уравнения Лапласа с различными краевыми условиями. Однако кинетические закономерности электрохимической коррозии металлов и для такой поверхности остаются справедливыми.
Искомые распределения потенциала могут быть найдены указанным способом лишь при известных для каждого участка поверхности значениях k а и b а, k к, b к и с Oх (или i д). Основной электрохимический механизм коррозии металлов, выражаемый уравнениями (1а) и (16), может иметь варианты. Реакция (1а) при z/2 может протекать через одноэлсктронныс стадии, например, при z=2:
М=М ++е, (6а)
М +=М 2++е. (6б) Катион промежут. валентности М + в некоторых случаях настолько устойчив, что может вступать в химическую реакцию
2М ++Ох=2М 2++Red (7)
прежде, чем успевает произойти его электрохим. анодное доокисление по реакции (6б).
Если при этом одновременно протекает реакция (16), реализуется так называемый электрохимическо-химический механизм, при котором коррозия металлов обусловлена электрохимическими реакциями (6а) и (6б) и химической реакцией (7). Если на металлической поверхности вместо окислителя Ох, который из-за реакции (7) не достигает ее, восстанавливаются катионы М 2+ (М 2++е=М +, рис. 1,в), осуществляется так называемый каталитический механизм коррозии металлов, при котором М + играет роль катализатора реакции (1).
Эти варианты электрохим. механизма возможны в водных средах, но могут быть наиболее существенными при коррозии металлов в органических средах. Для таких сред, обычно характеризующихся малыми значениями (ранее считалось обязательным протекание коррозии металлов по так называемому химическому механизму, когда передача всех zэлектронов от М к Ох происходит непосредственно, в одном элементарном акте.
В действительности же для электрохим. коррозии металлов объемная величина х не имеет принципиального значения, по этому механизму протекает коррозия металлов во многих малоэлектропроводных органических средах; возможность химического механизма сейчас допускают лишь для раствов на основе неполярных растворителей. В то же время в электропроводных водных растворах (кислых и слабокислых) для ряда металлов при электродных потенциалах более отрицательных, чем E кор (а при повышенных температурах — и вблизи E кор), скорость растворения не зависит от Е, причем этот экспериментальный факт не может быть объяснен диффузионными ограничениями.
Одной из возможных причин его существования считают протекание реакции (1) по химическому механизму. Классификация коррозии металлов определяется конкретными особенностями среды и условиями протекания процесса (подводом окислителя, агрегатным состоянием и отводом продуктов коррозии, возможностью пассивации металла и др.).
Обычно выделяют коррозию металлов в природных средах — атмосферную коррозию, морскую коррозию, подземную коррозию, биокоррозию; нередко особо рассматривают коррозию металлов в пресных водах (речных и озерных), гсотeрмальных, пластовых, шахтных и др. Еще более многообразны виды коррозии металлов в технических средах; различают коррозию металлов в кислотах (неокислительных и окислительных), щелочах, органических средах (например, смазочноохлаждающих жидкостях, маслах, пищевых продуктах и др.), бетоне, расплавах солей, оборотных и сточных водах и др.
По условиям протекания наряду с контактной и щелевой коррозией металлов выделяют коррозию по ватерлинии, коррозию в зонах обрызгивания, переменного смачивания, конденсации кислых паров; радиационную коррозию металлов, коррозию при теплопередаче, коррозию блуждающими токами и др. Особую группу образуют коррозионномех. разрушения, в которую входят помимо коррозионного растрескивания и коррозионной усталости фреттинг — коррозия, водородное охрупчивание, эрозионная коррозия (в пульпах и суспензиях с истирающими твердыми частицами), кавитационная коррозия (при одноврем. воздействии агрессивной среды и кавитации).
В общем случае воздействие агрессивной среды и механических факторов на разрушение неаддитивно. Например, при эрозионной коррозии металлов потери металла вследствие разрушения защитной пленки может 6ыть намного больше суммы потерь от эрозии и коррозии металлов по отдельности. Часто коррозию металлов классифицируют также по отдельным металлам и их группам, по конкретным отраслям, производствам и объектам. Коррозией часто называют также происходящие при взаимодействии со средами процессы разрушения неметаллических материалов — полупроводников, бетона, полимеров, стеклопластиков и др.
Представления о коррозии металлов, коррозионностойких материалах и защите от коррозии, коррозионных испытаниях, проводимых при разработках и выборе материалов и ср-в защиты, выделяются в самостоятельную научно-техническую дисциплину — химическое сопротивление материалов.
Лит.: Шлугeр М. А., Ажогин Ф. Ф., Ефимов М. А., Коррозия и зашита металлов, М., 1981; Коррозия. Справочник, под ред. Л. Л. Шрайера, пер. с англ., М.. 1981; Кeшe Г., Коррозия металлов, пер. с нем., М., 1984; Колотыркин Я. М., Металл и коррозия, М., 1985; Томашов Н. Д.. Чернова Г. П., Теория коррозии и коррозионно-стойкие конструкционные сплавы. М.. 1986.
Л. И. Фрейман.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988, Сайт http://dic.academic.ru, Словари и энциклопедии на Академике
Полностью Приложение к Словарю отходов смотрите здесь:
Словарь отходов смотрите здесь:
https://konsulmir.com/prilozhenie-k-slovaryu-otxodov-kompostirovanie-korroziya-metallov/Книги, СловариПриложение к Словарю отходовПриложение к Словарю отходов Автор - составитель: Обухов Евгений Николаевич Компостирование - Коррозия металлов Компостирование I Компостирование - способ обезвреживания бытовых, сельскохозяйственных и некоторых промышленных твердых отбросов, основанный на разложении органических веществ микроорганизмами. К. не подлежат больничные отбросы, субпродукты из ветлабораторий и отдельно фекалии. К компосту не допускаются примеси ядохимикатов, радиоактивных, дезинфицирующих и других...konsulmir konsulmir@yandex.ruAdministratorОрганизации и консульства. Праздники, календари, выходные. Справочная информация. Анекдоты, юмор