Приложение к Словарю отходов Метан — Методические рекомендации
Приложение к Словарю отходов
Автор — составитель: Обухов Евгений Николаевич
Метан — Методические рекомендации по определению класса токсичности промышленных отходов
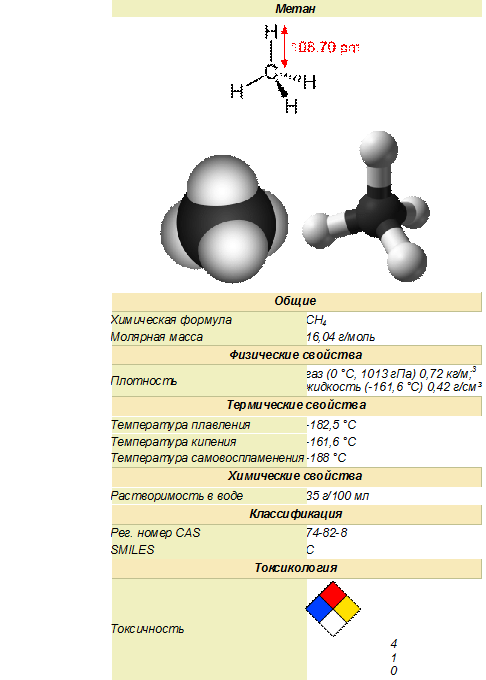 |
Метан — простейший углеводород, бесцветный газ без запаха, химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа». Сам по себе метан не токсичен и не опасен для здоровья человека.
Метан — первый член гомологического ряда насыщенных углеводородов, наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью. Специфична для метана реакция с парами воды, которая протекает на Ni/Al2O3 при 800—900 °C или без катализатора при 1400—1600 °C; образующийся синтез-газ может быть использован для синтеза метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Взрывоопасен при концентрации в воздухе от 5 % до 15 %. Самая взрывоопасная концентрация 9,5 %.
Источники
Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Получается также при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению:
- абиогенный — образован как результат химических реакций неорганических соединений;
- биогенный — образован как результат химической трансформации органического вещества;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий;
- термогенный — образован в ходе термохимических процессов.
Интересно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси.
Получение
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ацетатом натрия.
NaOH+CH3COONa→(t)Na2CO3+CH4↑
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов.
Вступает с галогенами в реакции замещения (например, CH4 + 3Cl2= CHCl3+ 3HCl), которые проходят по свободно радикальному механизму:
CH4 + ½Cl2 = CH3Cl (хлорметан)
CH3Cl + ½Cl2 = CH2Cl2 (дихлорметан)
CH2Cl2 + ½Cl2 = CHCl3 (трихлорметан)
CHCl3 + ½Cl2 = CCl4 (тетрахлорметан)
Выше 1400° С разлагается по реакции:
2CH4 = C2H2 + 3H2
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм по цепному радикальному механизму:
CH4 + 3[O] = HCOOH + H2O
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Применение
- Топливо.
- Продукты хлорирования используются в огнетушителях, как снотворное, или растворитель.
- Производство продукта дегидрирования-ацетилена.
- Продукт конверсии-синтез-газ. Используется для производства метанола и формальдегида, а следовательно и полимеров, медикаментов и денатурирующих и дезинфицирующих материалов. Также из синтез-газа изготавливаются аммиак и удобрения.
Метан и экология
Является парниковым газом. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 21 единицу. [1].
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3.
Википедия, сайт http://ru.wikipedia.org
Метан — болотный газ, рудничный газ, CH4 (aнгл. methane), — природный горючий газ, встречающийся в осадочном чехле земной коры в виде свободных скоплений (залежей), в растворённом (в нефти, пластовых и поверхностных водах), рассеянном, сорбированном (породами и органич. веществом) и твёрдом (газогидратном) состояниях. Плотность метана по воздуху 0,555 (20°C); молекулярная масса 16,04, tпл -182,49°C, tкип — 161,56°C, критическое давление 4,58 МПa, критическая температуpa — 82,4°C, вспышки -187,8°C, самовоспламенения 537,8°C.
Mетан — первый член гомологического ряда насыщенных (метановых) углеводородов. Молекулу метана представляют в виде тетраэдра c атомом углерода в центре. Величина связи C-H 1,09 Hм. Mетан — бесцветный газ c лёгким чесночным запахом, горящий слабо светящимся пламенем. При обычной температуpe c большинством химических элементов не реагирует. Обладает высокой термич. устойчивостью и начинает заметно разлагаться при t 600°C. Растворимость метана в нефти в 10 раз больше, чем в воде. Удельная теплота сгорания (50,049 МДж/кг) почти в 2,5 раза больше, чем y каменного угля.
Mетан является основным компонентом газов природных горючих (до 99,5%), нефтяных попутных (39-91%), болотных (свыше 99%) и рудничных (34-48%) газов; присутствует в газах грязевых вулканов (свыше 95%), спорадически встречается в вулканических газах и в газах магматических и метаморфических пород, a также в микровключённых газах. Большое количество метана растворено в водах океанов, морей, озёр, газы которых иногда представляют промышленный интерес (озеро Киву, Центральная Африка).
Cpеднее содержание метана в водах Мирового океана порядка 10-2 см3/л, общее — 14·* 1012 м3. Количество метана, растворённого в пластовых водах, на несколько порядков выше его промышленных запасов. Значительное количество метана сорбировано породами (при давлении 40 МПa глины сорбируют 2600 см3/кг M.). B угленосных толщах метан находится в свободном и сорбированном состояниях (240-260 трлн. м3). Метаморфизм углей сопровождается выделением огромных объёмов метана, в несколько раз превышающих запасы известных газовых месторождений.
Содержание сорбированного газа преобладает над свободным, сорбционная ёмкость углей по метану увеличивается co степенью метаморфизма (углефикации) углей. B геологических закрытых угленосных бассейнах за счёт газов угольных пластов могут сформироваться газовые залежи. Mетан присутствует также в атмосферах Земли (около 6·* 1012 м3), Юпитера, Сатурна, Урана; в газах поверхностного грунта Луны.
Mетан в определённых термодинамических условиях образует газовые растворы, обладающие большой подвижностью и способствующие развитию миграции нефти и газа. При низких температурx метан образует газовые гидраты — твёрдые кристаллич. вещества плотностью 880-890 кг/м3, похожие на снег или лёд. Гидратообразование происходит в пористой среде осадочного чехла c формированием Газогидратных залежей.
C воздухом метан образует взрывчатые смеси.
Особую опасность представляет метан, выделяющийся при подземной разработке месторождений полезных ископаемых в горных выработках, a также на угольных обогатительных и брикетных фабриках, сортировочных установках. При содержании в воздухе до 5-6% метан горит около источника тепла (температуpa воспламенения 650-750°C), при содержании 5-16% — взрывается, свыше 16% — может гореть при притоке кислорода, снижение при этом концентрации метана взрывоопасно.
После контакта c источником тепла воспламенение происходит c некоторым запаздыванием. Ha этом свойстве основано создание предохранителей взрывчатых веществ и взрывобезопасного электрооборудования. Ha объектах, опасных по метанообильности, вводится газовый режим.
Основная масса метана лито- и гидросферы образуется при биохимической и термо-каталитической деструкции рассеянного органического вещества, углей и нефтей. B процессе погружения осадка, a затем породы образование метана происходит непрерывно, но c разной интенсивностью и заканчивается при полной метаморфизации пород.
Ha ранних стадиях преобразования отложений (диагенез) генерация метана связана c деятельностью анаэробных микроорганизмов, завершают процесс метанообразующие бактерии. B общем случае биохимическая зона образования метана ограничивается глубиной (температурой) существования бактерий. Наиболее активна их деятельность при 25-45°C, некоторые из них могут существовать при 100°C.
C погружением пород на большие глубины главная преобразующая роль отводится термокаталитич. реакциям, в результате которых вместе c метаном образуется большое количество жидких углеводородов (главная зона нефтеобразования). Ниже этой зоны генерируется преимущественно метан. Часть его имеет термометаморфическое, радиохимическое и космическое происхождение.
Mетан широко используется как топливо и сырьё для промышленности. Хлорированием метана производят метилхлорид, метиленхлорид, хлороформ, тетрахлорид углерода. При неполном сгорании метана получают сажу, при каталитическом окислении — формальдегид, при взаимодействии c серой — сероуглерод. Термоокислительный крекинг и электрокрекинг метана — важные промышленные методы получения ацетилена.
Каталитическое окисление смеси метана c аммиаком лежит в основе промышленного производства синильной кислоты, метан используется как источник водорода при промышленном получении аммиака, a также водяного газа, применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и др. Важное производное метана — нитрометан.
Исторический очерк. Осн. источник метана — природный газ, известен человечеству за много столетий до нашей эры. Древние римляне были знакомы c горючими свойствами газов, выделяющихся из трещин Земли («вечные огни»). Ha месте таких выходов греки построили храм «богу небесного и земного огня» и назвали гору Химерой в честь огнедышащего фантастич. чудовища.
Огни Химеры горели свыше 3 тыс. лет. Многочисл. горящие источники издавна известны в Иране, Азербайджане, Ираке и других местах. Обилие их в Иране привело к созданию там в 7 веке религии огнепоклонничества, распространившейся и в другие места. Широко были известны «огнедышащие грязевые горы» — грязевые вулканы. B 15 веке отмечены случаи взрывов рудничного газа. Болотный газ был известен ещё раньше. Однако после описания англичанина Г. Кавендиша (1766) водорода как «горючего воздуха» некотоpoe время все горючие газы отождествлялись c водородом.
A. Вольта (1776) установил отличие болотного газа от водорода и газов перегонки растительных масел. K. Бертолле (1785) доказал, что болотный газ состоит в основном из метана и содержит примесь азота. Количественное соотношение углерода и водорода в болотном газе определено Дж. Дальтоном (1805). Синтез метана осуществил Л. Мельзенс (1845) по схеме CCl → CH4, использовав в качестве восстановителя амальгаму калия. П. Бертло получил метан непосредственно из сероуглерода, пропуская его пары вместе c сероводородом над медью, a также перегонкой формиата бария (1858).
Л. Нечаева.
Горная энциклопедия. — М.: Советская энциклопедия. Под редакцией Е. А. Козловского. 1984—1991, Сайт http://dic.academic.ru, Словари и энциклопедии на Академике
Метановое брожение — по — другому иногда неверно называется анаэробным брожением, — процесс биодеструкции органических веществ с выделением свободного метана.
Органические соединения + Н2О→ СН4+СО2+С5Н7NО2+NH4+HCO3.
Органические соединения (белки, углеводы, жиры), которые присутствуют в биомассе, начинают распадаться на простейшие органические соединения (аминокислоты, сахара, жирные кислоты) под действием гидролитических ферментов. Эта стадия называется — гидролизом и протекает под воздействием ацетогеных бактерий. На второй стадии происходит гидролизное окисление части простейших органических соединений под воздействием гетероацетогеных бактерий, в результате которой получается ацетат, двуокись углерода и свободный водород.
Другая часть органических соединений с полученным ацетатом на 2 стадии ацетатом образует С1 соединения (простейшие органические кислоты). Полученные вещества являются питательной средой для метанобразующих бактерий 3 стадии. 3 стадия протекает по двум процессам, вызванные различной группой бактерий. Эти две группы бактерий преобразуют питательные соединения 2-ой стадии в метан СН4, воду Н20, двуокись углерода.
Процесс анаэробного брожения происходит в бактериальной биомассе и включает конверсию сложных органических соединений — полисахаров, жиров и белков в метан СН4 и оксид углерода СО (4).
По пищевым потребностям бактерии разделяются на три вида: 1 вид — гидролизные или ацетогеные. Этому виду принадлежат протеолитические, целлюлолитические, облигатные анаэробы, факультативные анаэробы. К 2-му виду относят — гомоацетатные бактерии. К 3-му виду относят метаногенные бактерии — хемолитотрофные бактерии З стадии, перерабатывающие оксид углерода и водород на метан и воду стадия А, и бактерии стадии В — ниткоподобные палочки, коки и ланцетоподобные, которые перерабатывают муравьиную и уксусную кислоты а также метанол на метан и оксид углерода.
Кроме природных субстратов анаэробные популяции расщепляют фенолы и сернистые соединения. В зависимости от состава раствора биомассы и вида бактерий, в биологическом реакторе будет происходит изменение значений рН, температуры и редокс-потенциала среды.
Википедия, сайт http://ru.wikipedia.org
Метаногенез, биосинтез метана — процесс образования метана анаэробными археями, сопряжённый с получением ими энергии. Существует три типа метаногенеза:
- Восстановление одноуглеродных соединений с помощью молекулярного водорода или двух- и более углеродных спиртов.
- Диспропорционирование одноуглеродных соединений.
- Диспропорционирование (кажущееся декарбоксилирование) ацетата.
Энергия при этом запасается в форме натриевого или протонного трансмембранного потенциала и трансформируется АТФ-синтазами в химическую (связей в молекуле АТФ).
Метаногенез играет важную роль в природе, являясь основным источником метана в земной атмосфере. Используется человеком для получения биогаза.
Биохимия процесса
В процессе метаногенеза принимают участие специфические коферменты: метанофуран, тетрагидрометаноптерин (H4МП), коферменты F420 и , кофермент M, кофермент B. H4МП и метанофуран найдены у метилотрофных бактерий, H4МП, F420 и кофермент B имеют сходство с коферментами, найденными у бактерий и эукариот, F430 и кофермент M не имеют аналогов у других организмов.
Наиболее хорошо изучен процесс восстановления углекислого газа до метана.
CO2 + 4 H2 → CH4 + 2H2O
На первой стадии одноуглеродный остаток присоединяется к тетрагидрометаноптерину, после чего дегидратируется и восстанавливается до уровня формальдегида либо молекулярным водородом, либо при участии F420. После этого происходит ещё одно восстановление и полученная метильная группа переносится на кофермент M.
Метил-S-CoM восстанавливается коферментом B до метана при участии метил-CoM-редуктазы и с образованием метана, а также гетеросульфида коферментов B и M. Все перечисленные реакции необратимы.
Энергия запасается при восстановлении гетеросульфида мембранным ферментативным комплексом гидрогеназы и гидродисульфид-редуктазы. Этот комплекс предположительно служит протонной помпой.
Осуществляющие процесс организмы
Способностью образовывать метан обладают около 50 видов из 17 родов, все из которых относятся к археям. Традиционно их рассматривают как группу метанобразующих бактерий, однако, филогенетически она весьма неоднородна. В IX определителе бактерий Берджи выделено три порядка метаногенов: Methanobacteriales, Methanococcales и Methanomicrobiales.
Все метаногены — строгие анаэробы, рост некоторых из них полностью подавляется при появлении в газовой фазе 0,004% кислорода, первые выделенные в чистые культуры виды ростли при окислительно-восстановительном потенциале среды менее -300 мВ. Большинство из них мезофилы и имеют оптимум роста в области 30-40°С, все имеют оптимум pH при 6,5-7,5, есть галофилы.
Около половины видов автотрофны и фиксируют углекислый газ по ацетил-КоА-пути, ряд из них способен к азотфиксации (Methanosarcina barkeri, Methanobacterium formicium). Сера усваивается чаще всего в восстановленной форме, возможно вовлечение в метаболизм молекулярной серы, сульфит-аниона. Лишь несколько видов (Methanobrevibacter ruminantium, Methanococcus thermolithrophicum) могут использовать сульфат-анион.
Окислять водород углекислым газом способны практически все метаногены, однако лишь два рода (Methanosarcina, Methanothrix) могут декарбоксилировать ацетат. При этом именно они дают наибольший вклад в глобальную эмиссию метана.
Экологическое значение
Метаногены завершают анаэробную деструкцию вещества, используя молекулярный водород, углекислый и угарный газы, а также низшие органические кислоты, выделяющиеся при процессах брожения. Более 20% мировых запасов метана имеют биогенное происхождение.
Википедия, сайт http://ru.wikipedia.org
Метаногены
Метаногены (methanogens) — это археи, которые образуют метан как побочный продукт метаболизма в бескислородных условиях. Широко распространены в заболоченных территориях, где образуют метан (болотный газ) и в кишечниках жвачных млекопитающих и человека, и отвечают за метеоризм. В глубинах океанов биосинтез метана археями обычно пространственно располагается в местах выхода сульфатов. Некоторые являются экстремофилами, и обитают в горячих источниках и на больших глубинах, а также на скалах и на глубине многих километров в земной коре.
Представители
- Methanobacterium bryantii
- Methanobacterium formicum
- Methanobrevibacter arboriphilicus
- Methanobrevibacter gottschalkii
- Methanobrevibacter ruminantium
- Methanobrevibacter smithii
- Methanocalculus chunghsingensis
- Methanococcoides burtonii
- Methanococcus aeolicus
- Methanococcus deltae
- Methanococcus jannaschii
- Methanococcus maripaludis
- Methanococcus vannielii
- Methanocorpusculum labreanum
- Methanoculleus bourgensis (Methanogenium olentangyi & Methanogenium bourgense)
- Methanoculleus marisnigri
- Methanofollis liminatans
- Methanogenium cariaci
- Methanogenium frigidum
- Methanogenium organophilum
- Methanogenium wolfei
- Methanomicrobium mobile
- Methanopyrus kandleri
- Methanoregula boonei
- Methanosaeta concilii
- Methanosaeta thermophila
- Methanosarcina acetivorans
- Methanosarcina barkeri
- Methanosarcina mazei
- Methanosphaera stadtmanae
- Methanospirillium hungatei
- Methanothermobacter defluvii (Methanobacterium defluvii)
- Methanothermobacter thermautotrophicus (Methanobacterium thermoautotrophicum)
- Methanothermobacter thermoflexus (Methanobacterium thermoflexum)
- Methanothermobacter wolfei (Methanobacterium wolfei)
- Methanothrix sochngenii.
Википедия, сайт http://ru.wikipedia.org
Метанобразующие бактерии — Биогаз образуется в результате разложения органических соединений животного и растительного происхождения. В составе биогаза основным компонентом является метан, который образуется в результате жизнедеятельности метанообразующих бактерий. Но метаногены не способны в одиночку преобразовать органические соединения в метан и углекислый газ, поэтому сначала в процессе участвуют кислотообразующие бактерии.
Эти микроорганизмы способны преобразовывать сложные органические соединения в более простые, к примеру, белки расщепляются до пептидов и аминокислот, углеводы становятся простыми сахарами, а жиры преобразуются в глицерин и жирные кислоты. После окончания первой фазы брожения образуются масляная, уксусная и пропионовая кислоты, спирты и альдегиды, а также ряд других неорганических соединений, к числу которых относятся сероводород, водород и аммиак. Только после этого к работе приступают метаногены.
Под действием ферментов и коферментов, вырабатываемых метанобразующими бактериями, завершается цикл брожения, в результате чего образуется метан и углекислый газ, входящие в состав биогаза. Метанобразующие бактерии относятся к разряду архебактерий. Они имеют особый аппарат синтеза белка и состав клеточных стенок, что позволяет им получать энергию и усваивать углекислоту. Размножаются метаногены очень медленно и проявляют повышенную чувствительность к изменениям окружающей среды.
Интенсивность газовыделения будет во многом зависеть от условий, созданных для жизнедеятельности метанобразующих бактерий. Низкая кислотность среды подавляет рост метаногенов, тем самым уменьшая полезный выход биогаза. Количество метана, содержащегося в биогазе, зависит от состава перерабатываемых органических веществ. Если в их составе содержатся жиры и протеины, то в результате получится биогаз с высоким содержанием метана. Но если биомасса состоит из растительных компонентов с большим содержанием углеводов, то содержание метана будет не высоким.
Поскольку они не способны выделять тепло, но существовать могут лишь в тепле, для повышения эффективности их работы требуется подогрев. В зависимости от необходимой для их жизнедеятельности температуры метаногены бывают психофильными, могут жить при температуре от +5° С до +20° С, мезофильные, живут при температуре от +30° С до +42° С, и термофильными, которые живут при температуре от +54° С до +56° С. Метаногенные бактерии не выносят резких перепадов температуры.
Кислотообразующие и метанобразующие бактерии содержатся в растениях, экскрементах животных и в воде. Обычно большое количество этих микроорганизмов можно встретить в болотах, где ощущается недостаток кислорода и имеются в наличие различные органические соединения. Они являются неотъемлемой частью анаэробного разложения органических веществ.
Для переработки биологической массы в специальных установках не требуется специального насаждения бактерий, поскольку они уже содержатся в ней. Экскременты животных содержат полный комплекс необходимых для их разложения микроорганизмов, поэтому для их переработки требуется лишь создать и поддерживать оптимальные условия для развития процесса брожения.
Сайт http://bio.bmpa.biz
Метан угольных пластов — содержится в угленосных отложениях. Метан угольных пластов формируется в результате биохимических и физических процессов в ходе преобразования растительного материала в уголь.
Является причиной взрывов в угольных шахтах. Метан угольных пластов — экологически более чистое, чем уголь, и эффективное топливо. Может добываться как самостоятельное ископаемое, и как попутный продукт, получаемый в процессе дегазации шахт перед добычей угля. В процессе дегазации шахты себестоимость добычи метана играет вторичную роль. Средствами дегазации, применяемыми на шахтах России, извлекается от 20 до 30 % общего объема выделяющегося метана.
Для добычи метана угольных пластов бурят неглубокие скважины — около 100 метров. Для увеличения газоотдачи применяется технология гидроразрыва пласта (англ. Hydravlic fracturing).
Запасы
Оценка геологических ресурсов метана угольных пластов, трлн м³
Страна — запасы
Россия — 78
США — 60
Китай — 28
Австралия — 22
Индия — 18
Германия — 16
ЮАР — 13
Украина — 8
Казахстан — 8
Польша — 3
ВСЕГО в мире: 240
Добыча
Промышленная добыча метана угольных пластов началась в США в начале 1980-х годов. В 2000 году в США было добыто 40 млрд м³ метана угольных пластов, что составляло 7 % суммарной добычи газа в стране.
В результате добычи угля в Китае выбросы метана в атмосферу составляют 6-19 млрд м³ в год. В 1996 году была учреждена Китайская Объединенная Корпорация по метану из угольных пластов (CUCBM). К 2009 году добыча газа выросла до 700 миллионов м³. В 2009 году началось строительство более 3600 буровых скважин для его добычи.
В России принята программа «Метан Кузбасса». Кузбасс может производить около 20 млрд м³ метана ежегодно. Запасы метана в Кузбассе оцениваются в 13 трлн м³. Программа «Метан-Кузбасс» реализуется в три этапа: поисково-оценочные и геологоразведочные работы (2008- 2009), опытно-промышленная эксплуатация и наращивание объемов добычи (с 2010), выход на проектную промышленную добычу. В 2010 году на Талдинской площади пущен первый промысел по добыче газа метана из угольных пластов Кузбасского бассейна.
Википедия, сайт http://ru.wikipedia.org
Методические рекомендации по определению класса токсичности промышленных отходов
1. Общие принципы
В основу определения класса токсичности промышленных отходов положен расчетный метод, включающий:
1.1. вероятностный принцип при оценке возможного влияния промышленных отходов на окружающую среду;
1.2. использование гигиенических регламентов и параметров токсикометрии как наиболее значимых при оценке возможного вредного влияния промышленных отходов;
1.3. оценку класса токсичности промышленных отходов сложного состава по химическим соединениям, определяющим уровень токсичности отходов;
1.4. оптимальное сочетание сравнительно доступных гигиенических, токсикологических и физико-химических параметров, позволяющих оценить вероятное вредное воздействие токсичных веществ на окружающую среду;
1.5. принцип взаимозаменяемости некоторых параметров.
2. Определение класса токсичности
2.1. Определение класса токсичности на основе ПДК /химических веществ в почве:
2.1.1. Расчет индекса токсичности (К i ) ведут по формуле
![]() (1)
(1)
где ПДК i — предельно допустимая концентрация токсичного химического вещества, содержащегося в отходе, в почве;
S — коэффициент, отражающий растворимость его в воде, безразмерный;
Св — содержание данного компонента в общей массе отходов, в т /т;
i — порядковый номер данного компонента.
Величину «К i » округляют до 1-го знака после запятой.
2.1.2. Рассчитав К i для отдельных компонентов отхода, выбирают 1-3 ведущих компонента, имеющих минимальное значение К i , причем К1<К2<К3, кроме того, должно выполняться условие: 2К1 ³ К3.
Затем определяется суммарный индекс токсичности (К S ) по формуле:
![]() (2)
(2)
где n £ 3, после чего определяют класс токсичности с помощью вспомогательной таблицы I .
Таблица I
Классификация опасности химических веществ на основе их ПДК в почве
| Расчетная величина К S по ПДК в почве | Класс токсичности | Степень опасности |
| Менее 2 | I | Чрезвычайно опасные |
| От 2 до 16 | II | Высоко опасные |
| Ос 16,1 до 30 | III | Умеренно опасные |
| Более 30 | IV | Малоопасные |
2.2. Определение класса опасности при отсутствии ПДК в почве.
2.2.1. Расчет индекса токсичности (К i ) ведут для каждого компонента смеси по формуле ( 3), используя величину ДЛ50 для данного компонента.
![]() (3)
(3)
где F — коэффициент летучести данного компонента, остальные обозначения те же, что в формуле ( 1).
Величину К i округляют до 1-го знака после запятой.
2.2.2. Ра c считав К i для отдельных компонентов смеси, выбирают несколько (не более трех) ведущих компонентов смеси, имеющих наименьшее значение К i ; причем К1<К2<К3, кроме того, должно выполняться условие: 2К1 ³ К3.
Затем ведут расчет суммарного индекса опасности (К S ) для смеси из двух или трех ведущих компонентов по формуле ( 2), после чего определяют класс опасности смеси с помощью вспомогательной таблицы II .
Таблица II
Классификация опасности химических веществ по ДЛ50
| Величина К S , полученная на основе ДЛ50 | Класс токсичности | Степень опасности |
| Менее 1,3 | I | Чрезвычайно опасные |
| От 1,3 до 3,3 | II | Высоко опасные |
| От 3,4 до 10 | III | Умеренно опасные |
| Более 10 | IV | Малоопасные |
2.3. Определение класса токсичности при отсутствии ПДК химических веществ в почве и ДЛ50.
При отсутствии ПДК в почве и ДЛ50 для некоторых компонентов отходов, но при наличии величин классов опасности в воздухе рабочей зоны в уравнение (3) подставляют условные величины ДЛ50, ориентировочно определяемые по показателю класса опасности в воздухе рабочей зоны с помощью вспомогательной таблицы III .
Таблица III
Классы опасности в воздухе рабочей зоны и соответствующие им условные величины ДЛ50.
| Класс опасности в воздухе рабочей зоны | Эквивалент ДЛ50, мг/кг |
| I | 15 |
| II | 150 |
| III | 6000 |
| IV | более 5000 |
3. Определение предельного содержания токсичных веществ в общей массе токсических отходов
Определение предельного содержания в отходах токсичных веществ (СПР) ведут по формуле:
![]() (4)
(4)
где
![]()
— логарифм величины ДЛ50 для того компонента смеси, для которого величина К, определяемая по формуле ( 3), является минимальной, т.е. для К1.
S ai — сумма отношений K 1 , K 2 , K 3 к минимальной величине К, т.е.
![]()
SI — коэффициент, отражающий растворимость компонента в воде, соответствующего К I .
FI — коэффициент летучести этого компонента, остальные обозначения см. выше.
К III — индекс токсичности, соответствующий III классу.
4. Определение величин ПДК в почве, ДЛ50, коэффициентов растворимости и летучести, входящих в уравнения ( 1 ) и ( 3 )
4.1. ПДК в почве и ДЛ50 находят по справочникам, приведенным в п. 6 «Литература» или с использованием других источников.
При наличии в справочниках нескольких величин ДЛ50 для различных видов теплокровных животных выбирают для расчета индекса токсичности наименьшее значение ДЛ50.
4.2. С помощью справочников, других литературных источников или экспериментально находят растворимость данного химического вещества или соединения в воде в граммах на 100 г воды при 25°С; эту величину делят на 100, получают безразмерный коэффициент S , который (в большинстве случаев) находится в интервале от 0 до 1.
4.3. С помощью справочников определяют давление насыщенного пара индивидуальных компонентов в смеси в мм рт. ст. (имеющих температуру кипения при 760 мм рт. ст. не выше 80°С) для температуры 25°С; полученную величину делят на 760 мм рт. ст., получают безразмерную величину F , которая находится в интервале от 0 до 1.
5. Примеры расчета индекса опасности
Предположим 10 т отходов, содержат 8 тонн CCl 4 и 2 т HgCl 2 .
5.1. Четыреххлористый углерод ( CCl 4 ). Температура кипения 76,5° C , растворимость в воде 0,08 г/100 г, т.е. S =0,0008; с помощью справочника химика, т.1 находим, что давление насыщенного пара равно 112,2 мм. рт. ст., отсюда F =0,15. Далее по справочнику Н.Ф. Измерова и соавт. определяем ДЛ50 — 9006 мг/кг (для мышей) и 6200 мг/кг (для крыс), 5760 мг/кг (морские свинки и кролики).
Отсюда
![]()
5.2. Ртуть хлорная (сулема) — HgCl 2 . Ее растворимость — 6,59 г HgCl 2 на 100 г воды, т.е. S =0,01659. Минимальное ДЛ50=17,5 мг/кг (для мышей); отсюда:
![]()
5.3.
![]()
, т.е. II класс опасности.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО НАУКЕ И ТЕХНИКЕ ВРЕМЕННЫЙ КЛАССИФИКАТОР
ТОКСИЧНЫХ ПРОМЫШЛЕННЫХ ОТХОДОВ И МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОПРЕДЕЛЕНИЮ КЛАССА ТОКСИЧНОСТИ
ПРОМЫШЛЕННЫХ ОТХОДОВ
№ 4286-87
Москва, 1987 г.
Полностью Приложение к Словарю отходов смотрите здесь:
Словарь отходов смотрите здесь:
https://konsulmir.com/prilozhenie-k-slovaryu-otxodov-metan-metodicheskie-rekomendacii/Книги, СловариПриложение к Словарю отходовПриложение к Словарю отходов Автор - составитель: Обухов Евгений Николаевич Метан - Методические рекомендации по определению класса токсичности промышленных отходов Метан - простейший углеводород, бесцветный газ без запаха, химическая формула - CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа». Сам по себе метан...konsulmir konsulmir@yandex.ruAdministratorОрганизации и консульства. Праздники, календари, выходные. Справочная информация. Анекдоты, юмор